摘要:19.CH4..C2H4.C3H4或C2H6.C4H4.C2H2 或CH4.C3H6.C2H2 . 解析:设三种气态烃的平均组成为CxHy CxHy+O2→x CO2+y/2 H2O △V 1 x+y/4 x 1+y/4 1+y/4=2 解得Y=4 即三种气态烃的平均氢原子组成为4. 三 实验题
网址:http://m.1010jiajiao.com/timu3_id_55643[举报]
(2010?济南二模)我国在青藏高原发现了名为“可燃冰”的环保型新能源.?
(1)“可燃冰”属于化石燃料,主要成分是CH4.另外还有两种化石燃料,它们的名称分别是
(2)CH4可与Cl2反应,反应历程如下?
①Cl-Cl→2Cl△H=243kJ?mol-1
②Cl?+CH3-H→CH3+H-Cl△H=4kJ?mol-1
③?CH3+Cl-Cl→CH3--Cl+Cl?△H=-106kJ?mol-1
则CH4与Cl2反应生成CH3-Cl(g)的热化学方程式为
(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图1所示:

则通入CH4的一极为原电池的
(4)CH4与H2O在隔绝空气、高温和催化剂条件下反应:CH4(g)+H2O(g)
CO(g)+3H2(g)△H=m kJ?mol-1?则反应的平衡常数表达式K=
,K的大小与温度(T)的关系如图2中曲线所示,则m
查看习题详情和答案>>
(1)“可燃冰”属于化石燃料,主要成分是CH4.另外还有两种化石燃料,它们的名称分别是
煤
煤
和石油
石油
.?(2)CH4可与Cl2反应,反应历程如下?
①Cl-Cl→2Cl△H=243kJ?mol-1
②Cl?+CH3-H→CH3+H-Cl△H=4kJ?mol-1
③?CH3+Cl-Cl→CH3--Cl+Cl?△H=-106kJ?mol-1
则CH4与Cl2反应生成CH3-Cl(g)的热化学方程式为
CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ?mol-1
CH4(g)+Cl2(g)→CH3Cl(g)+HCl(g)△H=-102 kJ?mol-1
.(3)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如图1所示:

则通入CH4的一极为原电池的
负极
负极
(填“正极”或“负极”),正极的电极反应式为O2+2H2O+4e-→4OH-
O2+2H2O+4e-→4OH-
.(4)CH4与H2O在隔绝空气、高温和催化剂条件下反应:CH4(g)+H2O(g)
| 催化剂 |
| 高温 |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
| c(CO)c3(H2) |
| c(CH4)c(H2O) |
>
>
0(填“>”“=”或“<”);改变某一条件,使状态从a点到达b点,若保持温度不变,反应再次达到平衡时,则CH4的转化率不确定
不确定
(填“增大”、“减小”、“不变”或“不确定”),反应的焓变(△H)将不变
不变
(填“增大”、“减小”或“不变”).二氧化碳碳捕获与封存技术(CCS)可以减少化石燃料燃烧以及其他工业用途的二氧化碳排放量,从而有助于减少温室气体的排放.该技术引起了各国的普遍重视.
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.
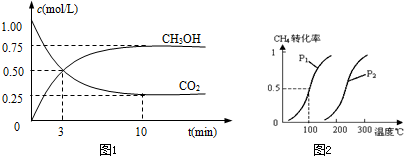
①从反应开始到平衡,氢气的平均反应速率v(H2)=
②下列措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
(2)反应①的△H1
,压强为P1,100℃时的平衡常数值是
查看习题详情和答案>>
Ⅰ.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图1所示.

①从反应开始到平衡,氢气的平均反应速率v(H2)=
0.225
0.225
mol/(L?min).②下列措施中能使n(CH3OH)/n(CO2)增大的是
CD
CD
.A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3molH2.
Ⅱ.工业上也可以通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1;②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol CH4和0.30molH2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图2.
(1)温度不变,缩小体积,增大压强,①的反应速率
增大
增大
(填“增大”、“减小”或“不变”),平衡向逆反应
逆反应
方向移动.(2)反应①的△H1
>
>
0(填“<”、“=”或“>”),其平衡常数表达式为K=| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
1.35×10-3
1.35×10-3
.
为了达到下列表格中的实验要求,请从下列化学试剂中选出合适的试剂,将其标号填入对应的空格中.
A.无水硫酸铜 B.溴的四氯化碳溶液 C.KMnO4酸性溶液 D.碘水
查看习题详情和答案>>
A.无水硫酸铜 B.溴的四氯化碳溶液 C.KMnO4酸性溶液 D.碘水
| 实验要求 | 选项的标号 |
| 证明马铃薯中含淀粉 | |
| 检验酒精中含水 | |
| 除去CH4中的C2H4 |
(2011?怀化一模)化学一化学与技术
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
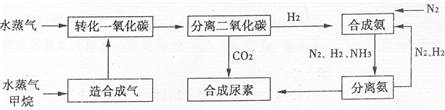
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
②
(2)依据流程圈,判断下列说法正确的是
A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
.降低温度K减小,则正反应是一个
查看习题详情和答案>>
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)

请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
2NH3+CO2
NH2COONH4
| ||
2NH3+CO2
NH2COONH4
;
| ||
②
NH2COONH4
CO(NH2)2+H2O
| ||
NH2COONH4
CO(NH2)2+H2O
.
| ||
(2)依据流程圈,判断下列说法正确的是
C
C
.A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
500℃的温度反应速率较快,催化剂活性最高
500℃的温度反应速率较快,催化剂活性最高
.(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
吸
吸
热反应.当造合成气的反应中甲烷的转化率为75%.合成氨中氢气的转化率为40%(其他过程的损失不计)以5.60xlO7L甲烷为原料能够合成4.48xlO7L
4.48xlO7L
L氨气.(假设体积均在标准状况下测定)