网址:http://m.1010jiajiao.com/timu3_id_55290[举报]
Fe2+、Fe3+离子作催化剂,标况下在转化器中SO2可被O2氧化成SO42-,实现SO2的回收利用。某同学设计测定转化器的脱硫效率方案如下

(2)在标准状况下用实验(Ⅱ)测定转化器中的脱硫效率,若已知气流流速,还需测定的数据是
_________ 和_________。
(3)实验室在一定条件下,将2mol SO2(g) 和1mol O2 (g) 充入20L密闭容器中,反应从起始到平衡后压强变为原来的11/15。请计算该条件下SO2的平衡转化率及SO3(g)
 SO2(g)+1/2O2(g)的平衡常数,写出计算过程:__________________________
SO2(g)+1/2O2(g)的平衡常数,写出计算过程:__________________________ (1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g)
| ||
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔).
①三个设备分别使反应物之间或冷热气体间进行了“对流”.请简单描述吸收塔中反应物之间是怎样对流的.
从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
从吸收塔顶部喷洒冷的浓硫酸,从上向下运动;热气体SO3与冷的浓硫酸相对流动,进行热量交换.
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的.用化学方程式表示其反应原理.(只写出2个方程式即可)
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+
 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________ 查看习题详情和答案>>
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+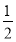 O2(g)
O2(g)  2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
查看习题详情和答案>>
 2SO3(g)△H=-98.3kJ?mol-1
2SO3(g)△H=-98.3kJ?mol-1