摘要:10.[南海中学2007-2008学年度第一学期高三月测]简单原子的原子结构可用下图形象地表示: 其中●表示质子或电子.○表示中子.则下列有关①②③的叙述正确的是 A.①②③互为同素异形体 B.①②③互为同位素 C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数 [解析]:根据图像.①②③分别是1H.2H.3H. [答案]:B
网址:http://m.1010jiajiao.com/timu3_id_54173[举报]
【南海中学2008届高三化学第一次月考】将下列物质分别加到溴水中,振荡后,因发生化学变化而使溴水褪色的是:①硫化钠②氢氧化钠③乙酸④镁粉⑤裂化汽油⑥甲苯
A.①②③⑤ B. ②④⑤⑥
C. ①②④⑤ D. ②③④⑤
查看习题详情和答案>>江苏省淮安中学2007届高三化学第二次月考试卷下列有关说法正确的是
- A.物质熔沸点的高低顺序是:氧化镁>氯化钠>冰>氖气
- B.微粒半径由大到小顺序是:O2->N3->Li+
- C.溶液中结合H+能力由强到弱的顺序是:SO42->H2PO4->CH3COO->HCO3-
- D.CO2、HClO、CF4、PCl3四物质分子中的所有原子都满足最外层为8电子的稳定结构
|
江苏省淮安中学2007届高三化学第二次月考试卷下列有关说法正确的是 | |
| [ ] | |
A. |
物质熔沸点的高低顺序是:氧化镁>氯化钠>冰>氖气 |
B. |
微粒半径由大到小顺序是:O2->N3->Li+ |
C. |
溶液中结合H+能力由强到弱的顺序是:SO42->H2PO4->CH3COO->HCO3- |
D. |
CO2、HClO、CF4、PCl3四物质分子中的所有原子都满足最外层为8电子的稳定结构 |
(2011?开封一模)某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质.某化学课外小组设计以下流程,以该矿样为原料生产CuCl2?2H2O晶体.
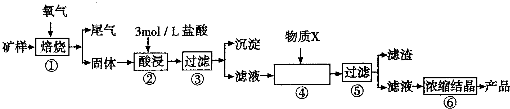
已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表.
回答下列问题:
(1)步骤①的焙烧过程中需要通入氧气.在实验室中使用中学化学常见物质用图1所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是

(3)步骤②酸浸过程中,需要用到3mol/L的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有
(4)步骤④加入物质X的目的是
A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行
查看习题详情和答案>>

已知:在20℃时,氯化铜的溶解度是73g;常温下,金属离子开始沉淀和沉淀完全时的pH见下表.
| 金属离子 | 开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
(1)步骤①的焙烧过程中需要通入氧气.在实验室中使用中学化学常见物质用图1所示装置制取氧气,试写出你熟悉的、符合上述条件的两个化学方程式
2H2O2
2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑
| ||
2H2O2
2H2O+O2 ↑、2Na2O2+2H2O=4NaOH+O2↑
| ||
(2)在焙烧过程中还有废气产生,其中一种是主要的大气污染物.若在实验室中以碱液吸收处理之,下列A、B、C装置中可行的是
AB
AB
(填字母);若选用甲装置,则烧杯中的下层液体可以是CCl4
CCl4
(填字母);
(3)步骤②酸浸过程中,需要用到3mol/L的盐酸100mL,配制该盐酸溶液时,除了用到烧杯、玻璃棒、胶头滴管外,还需要的仪器有
100ml的容量瓶,量筒
100ml的容量瓶,量筒
;(4)步骤④加入物质X的目的是
控制溶液的pH,使Fe3+以沉淀的形式全部沉淀
控制溶液的pH,使Fe3+以沉淀的形式全部沉淀
,物质X可以选用下列物质中的A
A
;A.氧化铜 B.稀盐酸 C.氨水 D.氧化亚铁
(5)在整个生产流程中,共需要进行
3
3
次过滤操作.硫酸和硝酸是中学阶段常见的强酸.根据二者与金属的反应情况,回答下列问题:
(1)①在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子方程式加以说明
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是
查看习题详情和答案>>
(1)①在100mL 18mol?L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
D
D
.A.33.6L B.22.4L C.20.16L D.6.72L②若向上述反应①的体系中再加入硝酸钠,有什么现象出现?用必要的文字和离子方程式加以说明
铜片继续溶解,有无色气体生成(无色气体后变为红棕色),有关离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
铜片继续溶解,有无色气体生成(无色气体后变为红棕色),有关离子方程式为:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
.3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集气体1.12L(标准状况),则该气体的成分是
NO2、NO
NO2、NO
,反应中所消耗的硝酸的物质的量可能为下列数据中的B
B
.A.0.1mol B.0.15mol C.0.2mol D.0.25mol.