摘要:酸式盐溶液呈酸性吗? 表面上看.“酸 式盐溶液当然呈酸性啦.其实不然.到底酸式盐呈什么性.要分情况讨论,当其电离程度大于水解程度时,呈酸性,当电离程度小于水解程度时,则成碱性.如果这是强酸的酸式盐.因为它电离出了大量的H+.而且阴离子不水解.所以强酸的酸式盐溶液一定呈酸性.而弱酸的酸式盐.则要比较它电离出H+的能力和阴离子水解的程度了.如果阴离子的水解程度较大(如NaHCO3,NaHS,Na2HPO4).则溶液呈碱性,反过来.如果阴离子电离出H+的能力较强.则溶液呈酸性.
网址:http://m.1010jiajiao.com/timu3_id_54117[举报]
下列说法正确的是( )
A.某二元弱酸的酸式盐![]() 溶液呈酸性:
溶液呈酸性:![]()
B.0.02mol/L的![]() (aq) 与0.02mol/L 的
(aq) 与0.02mol/L 的![]() (aq) 等体积混合得到碱性混合溶液中:
(aq) 等体积混合得到碱性混合溶液中:![]()
C.在物质的量浓度均为0.01mol/L的![]() 和
和![]() 的混合溶液中:
的混合溶液中:![]()
D.![]() 相等的
相等的![]() 溶液、
溶液、![]() 溶液、
溶液、![]() 溶液中:
溶液中:![]()
X、Y、Z、M是由短周期元素组成的化合物;X、Y、Z均含有钠元素,且Y、Z均含有三种元素;Z的溶液显碱性.请回答下列问题:
(1)X为淡黄色粉末,可作潜水艇的供氧剂,则X为
 .
.
(2)Y、Z、M有关实验如下表:
①Y中阴离子的结构如图所示,可以看成是SO42-中的一个O原子被S原子所替代,请写出Y与稀H2SO4反应的离子方程式:

②写出含0.1mol Z的溶液与20mL 2.5mol?L-1M的溶液反应的化学方程式:
(3)如图所示,横坐标表示常温下溶液的pH,纵坐标可表示Zn2+、[Zn(OH)4]2-浓度的对数值(lgc).请回答下列问题:

①ZnCl2溶液呈酸性的原因是
②往ZnCl2溶液中加入足量Z溶液,反应的离子方程式为:
查看习题详情和答案>>
(1)X为淡黄色粉末,可作潜水艇的供氧剂,则X为
过氧化钠
过氧化钠
.X中除钠元素外,其它元素的原子结构示意图为

(2)Y、Z、M有关实验如下表:
| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |
S2O32-+2H+═S↓+SO2↑+H2O
S2O32-+2H+═S↓+SO2↑+H2O
.
②写出含0.1mol Z的溶液与20mL 2.5mol?L-1M的溶液反应的化学方程式:
AlCl3+3NaOH=Al(OH)3 ↓+3NaCl
AlCl3+3NaOH=Al(OH)3 ↓+3NaCl
.(3)如图所示,横坐标表示常温下溶液的pH,纵坐标可表示Zn2+、[Zn(OH)4]2-浓度的对数值(lgc).请回答下列问题:

①ZnCl2溶液呈酸性的原因是
Zn2++2H2O
Zn(OH)2+2H+
| 水解 |
Zn2++2H2O
Zn(OH)2+2H+
.(用离子方程式表示)| 水解 |
②往ZnCl2溶液中加入足量Z溶液,反应的离子方程式为:
Zn2++4OH-═[Zn(OH)4]2-
Zn2++4OH-═[Zn(OH)4]2-
.从图中数据可计算常温下Zn(OH)2的KSP为10-17
10-17
.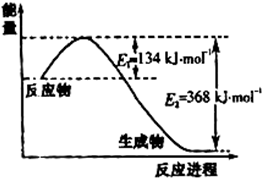 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答:(1)右图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g),其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1
②判断该反应达到化学平衡状态的依据是
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.
①写出盐酸肼第一步水解反应的离子方程式
②盐酸肼水溶液中离子浓度的排列顺序正确的是
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])>c(H+)>c(OH-)
C.2c(N2H62+)+c([N2H5?H2O]+)+c(H+)=c(H+)+c(OH-)
D.c(N2H62+)>c(Cl-)>c(H+)>c(OH-)
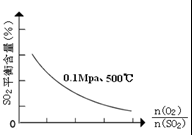 (1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
(1)在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:2SO2(g)+O2(g)
| 催化剂 |
| △ |
0~4min时,容器气体压强为101KPa.反应过程中,SO2、O2、SO3的物质的量(mol)的变化如下表:
| 时间min | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| n(SO2) | 2.00 | 1.92 | 1.84 | 1.76 | 1.76 | 1.64 | 1.52 | 1.40 | 1.40 | 1.40 |
| n(O2) | 1.00 | 0.96 | 0.92 | 0.88 | 0.88 | 0.82 | 0.76 | 0.70 | 0.70 | 0.70 |
| n(SO3) | 0 | 0.08 | 0.16 | 0.24 | 0.24 | 0.36 | 0.48 | 0.60 | 0.60 | 0.60 |
①
②第5min时,从速率和转化率两个方面分析,改变的外界条件是
③在0.1Mpa、500℃时,起始时O2和SO2的物质的量之比
| n(O2) |
| n(SO2) |
| n(O2) |
| n(sO2) |
(2)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol?L-1的H2C2O4溶液滴加0.01mol?L-1KOH溶液V(mL),回答下列问题.
①当V<10mL时,反应的离子方程式为
②当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-);
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+)/n(C2O42-)的值将
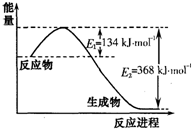 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(2)在定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)=2NH3(g),其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A、容器内N2、H2、NH3的浓度之比为1:3:2 B、2v(N2)(正)=v(H2)(逆)
C、容器内压强保持不变 D、混合气体的密度保持不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似.写出盐酸肼第一步水解反应的离子方程式