摘要:化学的学习过程中常用的科学思维方法有分析与综合.比较与分类.抽象与概括等.此外还要掌握类比.假说.建立模型等科学的推理方法.作为选拔高一级人才的高考化学试题.理应加强对学生综合思维能力的考查. 例4. 工业上生产Na.Ca.Mg都用电解其熔融态的氯化物.但K却不能用电解熔融KCl的方法来制取.因为金属钾易溶于熔态的KCl中而有危险.难以获得钾.且降低电流效率.工业上通常用金属钠和氯化钾在高温下反应制取.该反应为:Na NaCl △H>0.各物质的有关数据如下表: 物质 熔点/℃ 沸点/℃ 密度/g·cm3 Na 97.8 883 0.97 K 63.7 774 0.86 NaCl 801 1465 2.165 KCl 770 1437 1.984 (1) 工业上制取金属钾的化学原理是 .在常压下金属钾转为气态从反应混合物中分离的最低温度约为 .而反应的最高温度应低于 . (2)在制取金属钾的过程中.为了提高原料的转化率可采取的措施是 . (3)常压下.将反应温度升高到900℃时.该反应的平衡常数可以表示为 K= . 解析:由题中信息知.工业上冶炼金属钾的化学原理是化学平衡移动原理.反应控制的温度范围应至少大于金属钾的沸点.而小于金属钠的沸点.(当然也不高于KCl.NaCl的沸点),在制备钾的过程中.为提高原料的利用率.即想法使反应向右移动.所以可采取的措施有:适当的升高温度.降低压强或移去钾蒸气.(3)在900℃时.反应方程式中物质Na也为气态.故此时的平衡常数K=c. 答案:(1)化学平衡移动原理 774℃ 883℃ (2)适当的升高温度.降低压强或移去钾蒸气 [点评]:本题以冶炼金属钾这一新的知识点来考查学生的综合思维能力.要求同学在解答试题时以化学平衡移动原理为依据.以演绎推理为判据.用合成氨等平衡移动的应用为思维原型进行类比推理.形成思维迁移的起点.望同学们深刻领悟此题的考查意境和解答方法. 能力训练:1.已知反应:3A2C(g) △H<0.现向甲容器中充入3molA和1molB.向乙容器中充入a molC.若初始时两容器的温度.体积都相同.且甲容器能保持恒温恒压.乙容器能保持恒温恒容.则反应一段时间后.两容器中A的物质的量分数相同.下列说法中正确的是 ( ) A.a<2 B.a=2.并增大甲的压强 C.a>2 D.a=2.并降低乙的温度
网址:http://m.1010jiajiao.com/timu3_id_53666[举报]
(2012?通州区一模)有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置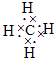
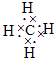 ;
;
(2)工业上制取Y单质常用的方法是
(3)Y离子半径比Z离子的半径
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,写出反应的化学方程式
(5)Z的某种盐是常用的净水剂,用离子方程式表示其净水原理
(6)举出实例说明M的非金属性比X强(用化学方程式表示)
查看习题详情和答案>>
| 元素 | 结构、性质等信息 |
| X | 构成有机物的主角,该元素的一种氧化物和气态氢化物都是典型的温室气体. |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质. |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性. |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂. |
(1)X元素在周期表中的位置
第二周期第IVA族
第二周期第IVA族
;其气态氢化物的电子式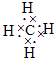
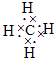
(2)工业上制取Y单质常用的方法是
电解法
电解法
;(3)Y离子半径比Z离子的半径
大
大
(填“小”或“大”);(4)Z的单质和氧化铁反应可用于野外焊接钢轨,写出反应的化学方程式
2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
;
| ||
(5)Z的某种盐是常用的净水剂,用离子方程式表示其净水原理
Al3++3H2O?Al(OH)3(胶体)+3H+
Al3++3H2O?Al(OH)3(胶体)+3H+
;(6)举出实例说明M的非金属性比X强(用化学方程式表示)
Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
.下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.

请你根据表中所给元素,回答下列问题:
(1)在短周期的所有元素中
(2)该表中金属性最强的元素与氧气反应生成化合物的化学式是
(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质做消毒杀菌剂的原因是
(4)写出分别由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式
(5)常温下某液态化合物只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性
查看习题详情和答案>>

请你根据表中所给元素,回答下列问题:
(1)在短周期的所有元素中
H
H
的原子半径与Na
Na
的原子半径之比最小(不包括稀有气体)(填元素符号).(2)该表中金属性最强的元素与氧气反应生成化合物的化学式是
K2O、K2O2
K2O、K2O2
(填两种即可).(3)海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,其单质做消毒杀菌剂的原因是
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
(用化学方程式表示).(4)写出分别由a、b、h、j四种元素所形成的两种化合物的水溶液相互反应的离子方程式
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
.(5)常温下某液态化合物只含上述元素中的两种,分子中原子个数比1:1,请你仅用一个化学方程式表示该液态化合物既有氧化性又有还原性
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
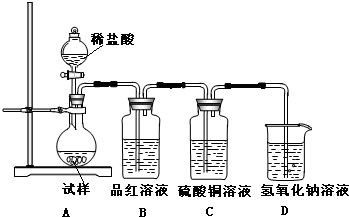 为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和图所示的实验装置进行实验.请回答下列有关问题:(1)若某种固体物质受热发生了分解,下列说法正确的是
D
D
A.充分加热后一定有固体残留
B.加热前后固体颜色一定无变化
C.加热前后固体质量一定有变化
D.一定生成了新的物质
E.充分加热后得到的残留固体一定为混合物
(2)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为
先逐渐增大,后逐渐减小
先逐渐增大,后逐渐减小
;(3)如果加热温度为700℃,向所得固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则固体试样跟盐酸反应生成淡黄色沉淀的离子方程式为
2S2-+SO32-+6H+=3S↓+3H2O
2S2-+SO32-+6H+=3S↓+3H2O
;此时在B、C两装置中可能观察到得现象为B中品红溶液褪色,C中无明显变化
B中品红溶液褪色,C中无明显变化
.(4)在(3)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X).为检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取
搅拌(或加热)
搅拌(或加热)
的措施.以下是检验阴离子(X)的两种实验方案,你认为合理的方案是乙
乙
(填“甲”或“乙”),请说明另一方案不合理的原因甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
甲中先加入具有强氧化性的稀HNO3,它能将SO32-氧化成SO32-,不能判定是否生成SO32-
.方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(5)写出Na2SO3固体加热到600℃以上分解的化学方程式
4Na2SO3
Na2S+3Na2SO4
| ||
4Na2SO3
Na2S+3Na2SO4
.
| ||
有四种短周期元素,它们的结构、性质等信息如下表所述:
请根据表中信息填写:
(1)X元素在周期表中的位置
(2)工业上制取Y单质常用的方法是(用化学方程式表示)
(3)Y离子半径比Z离子的半径
(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于
(5)举出实例说明M的非金属性比X强(用化学方程式表示)
查看习题详情和答案>>
| 元素 | 结构、性质等信息 |
| X | 构成有机物的核心元素,该元素的一种氧化物和气态氢化物都是典型的温室气体 |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质 |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性 |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
(1)X元素在周期表中的位置
第二周期ⅣA族
第二周期ⅣA族
;其相对分子质量最小的气态氢化物常用作燃料
燃料
.(2)工业上制取Y单质常用的方法是(用化学方程式表示)
2NaCl(熔融)
2Na+Cl2↑
| ||
2NaCl(熔融)
2Na+Cl2↑
.
| ||
(3)Y离子半径比Z离子的半径
大
大
(填“大”或“小”)(4)Z的单质和氧化铁反应可用于野外焊接钢轨,该反应属于
放热
放热
(填“吸热”或“放热”)反应,写出反应的化学方程式2Al+Fe2O3
Al2O3+2Fe
| ||
2Al+Fe2O3
Al2O3+2Fe
.
| ||
(5)举出实例说明M的非金属性比X强(用化学方程式表示)
Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
Na2CO3+2HClO4=2NaClO4+CO2↑+H2O
.
为探究亚硫酸钠的热稳定性,某研究性学习小组将无水亚硫酸钠隔绝空气加热,并利用受热后的固体试样和如下图所示的实验装置进行实验.请回答下列有关问题:

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为 ;
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为 ;此时在B、C两装置中可能观察到的现象为 或 .
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为 .检验该阴离子(X),先取固体试样溶于水配成溶液,为了加速固体试样的溶解,可采取 措施.以下是检验阴离子(X)的两种实验方案,你认为合理的方案是 (填“甲”或“乙”).
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式 .
查看习题详情和答案>>

(1)查阅资料:无水亚硫酸钠隔绝空气受热到600℃才开始分解,且分解产物只有硫化钠和另外一种固体.如果加热温度低于600℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,在滴加稀盐酸的整个过程中HSO3-的物质的量浓度变化趋势为
(2)如果加热温度为700℃,向所得冷却后固体试样中缓缓滴加稀盐酸至足量,观察到烧瓶中出现淡黄色沉淀,且有大量气泡产生,则反应生成淡黄色沉淀的离子方程式为
(3)在(2)中滴加足量盐酸后,烧瓶内除Cl-外,还存在另一种浓度较大的阴离子(X)为
方案甲:取少量试样溶液于试管中,先加稀HNO3,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
方案乙:取少量试样溶液于试管中,先加稀HCl,再加BaCl2溶液,有白色沉淀生成,证明该离子存在.
(4)写出Na2SO3固体加热到600℃以上分解的化学方程式