摘要:(一)思维定势失误 [例题1]据最新报道.科学家发现了如下反应 O2 + PtF6 = O2(PtF6).已知O2(PtF6)为离子化合物.其中Pt为+5价.对于此反应.下列说法正确的是 A.在此反应中.O2氧化剂.PtF6是还原剂 B.O2(PtF6)中氧元素的化合价为+1价 C.在此反应中.每生成1 mol O2(PtF6) 则转移1 mol电子 D.在O2(PtF6)中不存在共价键 解题思路: 由题O2(PtF6)中Pt为+5价.F只有-1价.所以O为+.O元素化合价升高作还原剂.PtF6是氧化剂.电子转移数目为1e-,O2(PtF6)为离子化合物.则O2+离子中存在着共价键. 答案 C 易错警示:氧化剂.还原剂的确定.要根据题设条件而定. O2参加反应.未必就作氧化剂. [例题2]0.96 g Mg跟含6.3gHNO3的稀溶液恰好反应完全.则HNO3还原产物的式量是: A.30 B.44 C.46 D.80 解题思路:根据氧化还原反应中,电子得失相等关系,可求出HNO3的还原产物中N的化合价为+1价.还原产物为N2O或NH4NO3 答案:BD 易错警示:本题最容易犯的错误就是不经过计算,仅根据金属与稀硝酸反应一般规律,就得出稀硝酸的还原产物为NO.而错选A答案.另外,计算了,得出 HNO3的还原产物中N的化合价为+1(N2O),但没有考虑到该+1价可能是平均化合价,还可能是NH4NO3漏选D答案
网址:http://m.1010jiajiao.com/timu3_id_53650[举报]
某同学进行胆矾结晶水测定实验,得到下(1)~(4)组数剧:
| |||||||||||||||||||||||
查看习题详情和答案>>
请你参与下列探究:
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式 .但却对气体的生成产生了疑问,这激发了同学们强烈的探究欲望,生成的是什么气体?
[提出猜想]从物质组成元素的角度,放出的气体可能是02.S02.H2.
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3.
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是02,则较简单的检验方法是 .
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与过量的NaOH溶液反应的化学方程式 .
(3)甲、乙同学的实验结果表明气体中既不含02也不含SO2,丙同学根据以上实验结果推测气体是H2.
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音.然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰的上方,气体在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热.结论:铁粉与硫酸铜的溶液反应时,产生的气体是 .
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有 物质.
查看习题详情和答案>>
[问题情景]某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时有较多的气泡放出.同学们都能解释红色固体物质的出现,请你写出生成红色固体物质的化学反应方程式
[提出猜想]从物质组成元素的角度,放出的气体可能是02.S02.H2.
[查阅资料]SO2易溶于水,它能与过量的NaOH溶液反应,生成Na2SO3.
[方案设计]依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是02,则较简单的检验方法是
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量.写出SO2与过量的NaOH溶液反应的化学方程式
(3)甲、乙同学的实验结果表明气体中既不含02也不含SO2,丙同学根据以上实验结果推测气体是H2.
[实验探究]丙同学为了检验H2,收集了一试管气体,用拇指堵住试管口且管口略向下倾斜靠近火焰移开拇指点火,听到很小的声音.然后再将气体用带尖嘴的导管导出点燃且用冷而干燥的烧杯罩在火焰的上方,气体在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热.结论:铁粉与硫酸铜的溶液反应时,产生的气体是
[思维拓展]由上述实验可以推出,硫酸铜溶液中可能含有
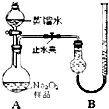 (2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.
(2011?宁德一模)某化学研究小组为测定Na2O2样品(仅含Na2O杂质)的纯度,设计了两种实验方案进行探究.[实验一]取样品0.100g,用如图所示实验装置进行测定.(夹持装置省略)
(1)检查装置A气密性的方法是
夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成
夹紧止水夹,向分液漏斗中加水,旋开活塞,一段时间后,若水不能顺利流下,证明气密性良好;或者关闭分液漏斗活塞,右侧的导管插入水中,用手捂住分液漏斗,看是否有气泡产生,冷却后是否有一段水柱形成
.(2)若在实验过程中共产生气体11.20mL(已折算成标准状况),则样品中Na2O2的纯度为
78%
78%
.[实验二]样品溶于水后用盐酸滴定
(3)取一定量样品溶于水并稀释至250mL,配制时,所用到的玻璃仪器除了烧杯和玻璃棒外,还需用到
250 mL容量瓶、胶头滴管
250 mL容量瓶、胶头滴管
.(4)取上述所配溶液各25.00mL,用一定浓度的标准盐酸滴定,平行实验记录如下表:
| 实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 标准盐酸体积(mL) | 23.00 | 24.98 | 25.00 | 25.02 |
25.00
25.00
mL.若滴定前用上述所配溶液润洗锥形瓶,对实验测定结果产生的影响是偏高
偏高
(填“偏高”、“偏低”或“无影响”).[实验分析]实验结果对比分析
(5)小组同学对比两个实验发现,实验一测得的Na2O2样品的纯度比理论值明显偏小.经过分析,小组同学认为,明显偏差不是由操作失误和装置缺陷引起的,可能是反应原理上的原因.查阅资料发现:Na2O2与水反应产生的H2O2未完全分解.
①写出Na2O2与水生成H2O2的化学方程式
Na2O2+2H2O=2NaOH+H2O2
Na2O2+2H2O=2NaOH+H2O2
.②若将实验一稍加改进,就能使测定结果接近理论值,写出改进方案:
反应前向Na2O2样品中加入少量MnO2
反应前向Na2O2样品中加入少量MnO2
.(2012?东城区模拟)牙膏是由摩擦剂和一些可溶于水的物质组成.常用的摩擦剂主要有:CaCO3、Al(OH)3、SiO2?nH2O、Ca3(PO4)2.资料显示:Ca3(PO4)2高温不分解;Ca3(PO4)2和CaHPO4不溶于水;Ca(H2PO4)2溶于水;Ca3(PO4)2+4H+=3Ca2++2H2PO4-.
(1)为测定某牙膏的酸碱性和摩擦剂的主要成分,甲同学设计并完成以下实验:
①取一小段牙膏与一定量蒸馏水充分搅拌后过滤,用pH试纸测定滤液酸碱性的方法是
②若向①所得不溶物中加入适量稀盐酸,得到澄清溶液,有气体产生,则产生气体的离子方程式是
③取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成,生成该沉淀的离子方程式是
(2)乙同学用如下装置(已检验气密性,夹持装置略)通过测CO2的质量来计算牙膏不溶物中CaCO3的含量.
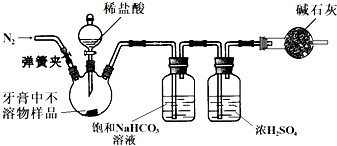
①滴加稀盐酸之前的部分操作:…打开弹簧夹,通入N2一段时间;再将盛有碱石灰的干燥管连接在整套装置上….按此顺序进行操作的原因是
②用上述装置重复几次实验,所测样品中CaCO3的含量均偏高,若实验过程中的操作没有失误,分析可能的原因是
③设计实验不用其他任何试剂(仪器可任选),仅用牙膏不溶物样品测定摩擦剂中CaCO3含量的方法是
查看习题详情和答案>>
(1)为测定某牙膏的酸碱性和摩擦剂的主要成分,甲同学设计并完成以下实验:
①取一小段牙膏与一定量蒸馏水充分搅拌后过滤,用pH试纸测定滤液酸碱性的方法是
用干燥洁净的玻璃棒蘸滤液,滴在pH试纸上,经与标准比色卡比较后
用干燥洁净的玻璃棒蘸滤液,滴在pH试纸上,经与标准比色卡比较后
(填相应操作),读出其pH接近8;②若向①所得不溶物中加入适量稀盐酸,得到澄清溶液,有气体产生,则产生气体的离子方程式是
CaCO3+2H+=Ca2++CO2↑+H2O
CaCO3+2H+=Ca2++CO2↑+H2O
;若向①所得不溶物中加入NaOH溶液,经测定,不溶物的质量不发生变化;③取②中加稀盐酸后所得溶液,加入过量NaOH溶液,观察到最终有沉淀生成,生成该沉淀的离子方程式是
2H2PO4-+3Ca2++4OH-=Ca3(PO4)2+4H2O
2H2PO4-+3Ca2++4OH-=Ca3(PO4)2+4H2O
;根据上述实验,摩擦剂中一定含有的物质是CaCO3、Ca3(PO4)2
CaCO3、Ca3(PO4)2
.(2)乙同学用如下装置(已检验气密性,夹持装置略)通过测CO2的质量来计算牙膏不溶物中CaCO3的含量.

①滴加稀盐酸之前的部分操作:…打开弹簧夹,通入N2一段时间;再将盛有碱石灰的干燥管连接在整套装置上….按此顺序进行操作的原因是
避免碱石灰吸收装置中原有空气中的CO2
避免碱石灰吸收装置中原有空气中的CO2
;②用上述装置重复几次实验,所测样品中CaCO3的含量均偏高,若实验过程中的操作没有失误,分析可能的原因是
干燥管中的碱石灰吸收空气中的CO2或H2O
干燥管中的碱石灰吸收空气中的CO2或H2O
或NaHCO3溶液除HCl时产生了CO2
NaHCO3溶液除HCl时产生了CO2
;③设计实验不用其他任何试剂(仪器可任选),仅用牙膏不溶物样品测定摩擦剂中CaCO3含量的方法是
称量不溶物样品在高温下完全分解前后的质量
称量不溶物样品在高温下完全分解前后的质量
(不必填具体操作).制冷剂是一种易被压缩、液化的气体,液化后在冷冻机的管道中循环,蒸发时吸收热量,使环境温度降低,达到制冷目的.人们曾采用过乙醚、氨、氯甲烷等制冷剂,但它们或者有毒,或者易燃.于是,科学家根据元素及其化合物性质的递变规律来研制新的制冷剂.请同学们回答下列问题:
某些元素及其化合物的易燃性、毒性变化规律如下:
(1)氢化物的可燃性:第二周期
(2)化合物的毒性:PH3>NH3;H2S
(3)已知CCl4的沸点是76.8℃,CF4的沸点是-128℃,新的制冷剂的沸点应该介于其间.经过经常时间的反复试验,一种新的制冷剂氟利昂-12(CCl2F2)终于诞生了,其它类似的氟利昂还可能有
(4)尽管这种制冷剂因为能够破坏大气中的
A.沸点 B.毒性 C.水溶性 D.颜色 E.易燃性.
查看习题详情和答案>>
某些元素及其化合物的易燃性、毒性变化规律如下:
(1)氢化物的可燃性:第二周期
CH4
CH4
>NH3
NH3
>H2O
H2O
>HF.(2)化合物的毒性:PH3>NH3;H2S
>
>
H2O;CS2>
>
CO2;CCl4>
>
CF4.于是,科学家们就把注意力集中在含有F、Cl的化合物上.(3)已知CCl4的沸点是76.8℃,CF4的沸点是-128℃,新的制冷剂的沸点应该介于其间.经过经常时间的反复试验,一种新的制冷剂氟利昂-12(CCl2F2)终于诞生了,其它类似的氟利昂还可能有
CCl3F、CClF3
CCl3F、CClF3
.(4)尽管这种制冷剂因为能够破坏大气中的
臭氧层
臭氧层
造成环境污染而逐渐被淘汰,但求助于元素周期表中元素及其化合物的ABE
ABE
(从下列各项中选取)变化趋势来开发研制制冷剂的科学思维方法是应该借鉴的.A.沸点 B.毒性 C.水溶性 D.颜色 E.易燃性.