网址:http://m.1010jiajiao.com/timu3_id_52343[举报]
(1)制取氧气
①用20%的H2O2溶液,通过反应2H2O2![]() 2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
2H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是_____________;
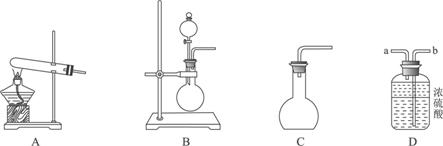
②与气体发生装置相连接的D装置的导管口是_____________;
③为了能使产生的氧气被充分干燥,可采取的操作是______________________________。
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2![]() 2CuO,②4CuO
2CuO,②4CuO![]() 2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
2Cu2O+O2↑;在酸性条件下:2Cu+(aq)====Cu(s)+Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有_____________,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是__________≤n<__________,则粉末X中含有Cu2O,其物质的量是__________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
查看习题详情和答案>>甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的H2O2溶液,通过反应2H2O2MnO22H2O+O2↑来制取氧气,则在下列A、B、C三装置中最佳装置是______
 |
②与气体发生装置相连接的D装置的导管口是______
③为了能使产生的氧气被充分干燥,可采取的操作是
_________________________________________________________________________________
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知:铜与氧气的反应有:①2Cu+O2△\s\up2 (——2CuO,②4CuO>1000℃2Cu2O+O2↑;在酸性条件下:2Cu+(aq)——Cu(s)+
Cu2+(aq)。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物并不一定是纯CuO,可能含有一定量的氧化亚铜(Cu2O)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有Cu2O,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X加入稀硫酸,若有 ,则说明固体中含有Cu2O。
乙同学的实验方案是:再将粉末X放入氧气中加热,如果其质量增加,则说明其中含有Cu2O。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。
若n的取值范围是 ≤n<_____,则粉末X中含有Cu2O,其物质的量是___________。
请你再设计一个与上述三个实验方案中现象不同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有Cu2O。写出该实验中离子反应的方程式。
查看习题详情和答案>>甲同学设计以下实验制取氧气和氧化铜。
(1)制取氧气
①用20%的![]() 溶液,通过反应
溶液,通过反应![]() 来制取氧气,则在下列A、B、C三装置中最佳装置是_____
来制取氧气,则在下列A、B、C三装置中最佳装置是_____

②与气体发生装置相连接的D装置的导管口是_____
③为了能使产生的氧气被充分干燥,可采取的操作是
(2)制取氧化铜
将m g铜粉在氧气流中加热到高温,使铜粉全部氧化,得n g粉末X。乙同学查阅资料知: 铜与氧气的反应有:①![]() ,②
,②![]() ;在酸性条件下:
;在酸性条件下:![]() 。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(
。由此得出结论:铜虽然全部氧化,但由于加热温度偏高,产物不一定是纯CuO,可能含有一定量的氧化亚铜(![]() )。
)。
(3)探究铜的氧化物的成分
为测定粉末X中是否含有![]() ,甲、乙、丙三同学分别设计如下实验方案。
,甲、乙、丙三同学分别设计如下实验方案。
甲同学的实验方案是:向粉末X中加入稀硫酸,若有___ ,则说明固体中含有![]() 。
。
乙同学的实验方案是:再将粉末X放人氧气中加热,如果其质量增加,则说明其中含有![]() 。
。
丙同学的实验方案是:通过分析实验数据就可以确定粉末X的成分。若n的取值范围是![]() ,则粉末X中含有
,则粉末X中含有![]() ,其物质的量是_____。
,其物质的量是_____。
请你再设计一个与上述三个实验方案中现象均不相同的实验方案,通过对化学反应和对实验现象的分析来确定粉末X中是否含有![]() 。写出该实验中反应的离子方程式。
。写出该实验中反应的离子方程式。
 哥本哈根世界气候大会全称《联合国气候变化框架公约》第15次缔约方会议暨《京都议定书》第5次缔约方会议,于2009年12月7~18日在丹麦首都哥本哈根召开.来自192个国家的谈判代表召开峰会,商讨《京都议定书》一期承诺到期后的后续方案,即2012~2020年的全球减排协议.
哥本哈根世界气候大会全称《联合国气候变化框架公约》第15次缔约方会议暨《京都议定书》第5次缔约方会议,于2009年12月7~18日在丹麦首都哥本哈根召开.来自192个国家的谈判代表召开峰会,商讨《京都议定书》一期承诺到期后的后续方案,即2012~2020年的全球减排协议.甲烷是温室气体之一,限制排放大气之一是甲烷气体.科学研究发现,甲烷产生温室效应比二氧化碳强.某化学学习小组为了探究同体积的甲烷和二氧化碳产生温室效应的强度大小,设计如下实验:分别收集同条件下体积相等的甲烷、二氧化碳两瓶气体,按图示装置连接,使红墨水柱Ⅰ和Ⅱ高度相等.放在太阳光下照射一段时间,观察现象.
(1)本实验设计原理是
(2)经过一段时间照射,预测实验现象和结论:
| 序号 | 预测现象 | 实验结论 |
| A | ||
| B | ||
| C |
①天然气与煤、柴油相比是较清洁的能源;
②等质量的CH4和CO2产生的温室效应也是前者大;
③燃烧天然气也是酸雨的成因之一.
其中正确的是
A.①②③B.①C.①②D.③
实验设计:验证氢气燃烧的产物中有无过氧化氢.(提示:若生成的过氧化氢的量有限,一旦分解就不易检验出来)
(1)实验原理:(略)
(2)实验用品:启普发生器、尖嘴导管、烧杯、酒精灯灯帽、火柴;锌粒、稀硫酸、8-羟基喹啉、酸化的淀粉碘化钾溶液.
(3)实验步骤
①制备用于得到过氧化氢的冰块:取5mL8-羟基喹啉倒入盛有100mL水的烧杯中,在混合液上倒放一酒精灯灯帽,置于冰箱中,冷冻得到冰块,拿去灯帽,冰块中间便有一直径约2cm、深约2cm的洞.
②氢气的制备:将锌粒与稀硫酸在启普发生器中反应.
③氢气的验纯.
④氢气的燃烧:在尖嘴导管口将已验纯的氢气点燃后,伸入冰块的洞内进行燃烧.
⑤验证过氧化氢的生成:冰块下方放一盛有少量新制淀粉碘化钾溶液的烧杯,将冰块熔化液(包括生成的水和可能生成的过氧化氢)滴入其中,观察发生的现象.
请回答下列问题:
(1)8-羟基喹啉的作用可能是
(2)实验需480mL4.6mol?L-1的稀硫酸,配制时需要量取18.4mol?L-1的浓硫酸的体积为
(3)简述氢气的验纯方法:
(4)有过氧化氢生成的现象是