摘要:要判断电解产物是什么.必须理解溶液中离子放电顺序 阴极放电的总是溶液中的阳离子.与电极材料无关.放电顺序是 K+.Ca2+.Na+.Mg2+.Al3+.Zn2+.Fe2+(H+).Cu2+.Hg2+.Ag+.Au3+ 放电由难到易 阳极:若是惰性电极作阳极.溶液中的阴离子放电.放电顺序是 S2-.I-.Br-.Cl-.OH-.含氧酸根离子(NO3-.SO42-.CO32-).F- 失电子由易到难 若是非惰性电极作阳极.则是电极本身失电子. 要明确溶液中阴阳离子的放电顺序.有时还需兼顾到溶液的离子浓度.如果离子浓度相差十分悬殊的情况下.离子浓度大的有可能先放电.如理论上H+的放电能力大于Fe2+.Zn2+.但在电解浓度大的硫酸亚铁或硫酸锌溶液时.由于溶液[Fe2+]或[Zn2+]>>[H+].则先在阴极上放电的是Fe2+或Zn2+.因此.阴极上的主要产物则为Fe和Zn.但在水溶液中.Al3+.Mg2+.Na+等是不会在阴极上放电的.
网址:http://m.1010jiajiao.com/timu3_id_51860[举报]
有A、B、C、D、E、F、G七种气体,它们分别是CO、O2、H2、CO2、Cl2、HBr、HCl中的一种.通过下列事实判断它们各是什么气体.
(1)A、B、C均难溶于水,D、E能溶于水,F、G易溶于水
(2)A和C都能在B中燃烧,火焰呈蓝色.A在B中燃烧的产物在通常状况下是液体,C在B中的燃烧产物是D.
(3)D是无色气体,能使澄清的石灰水变浑浊.
(4)A和E光照时能反应,生成物为F.
(5)将适量E通入G的水溶液中,溶液变为棕黄色.
(6)G的水溶液的pH小于7.在G的水溶液中滴加AgNO3溶液时,有沉淀生成.
A
查看习题详情和答案>>
(1)A、B、C均难溶于水,D、E能溶于水,F、G易溶于水
(2)A和C都能在B中燃烧,火焰呈蓝色.A在B中燃烧的产物在通常状况下是液体,C在B中的燃烧产物是D.
(3)D是无色气体,能使澄清的石灰水变浑浊.
(4)A和E光照时能反应,生成物为F.
(5)将适量E通入G的水溶液中,溶液变为棕黄色.
(6)G的水溶液的pH小于7.在G的水溶液中滴加AgNO3溶液时,有沉淀生成.
A
H2
H2
BO2
O2
CCO
CO
DCO2
CO2
ECl2
Cl2
FHCl
HCl
GHBr
HBr
.下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
请回答:
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
.
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(用K1、K2表示).③中的△H
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度 F.恒压的条件下通入He气
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率时间的关系线.
查看习题详情和答案>>
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
(1)反应①是
吸热
吸热
(填“吸热”或“放热”)反应.(2)写出反应③的平衡常数K3的表达式
| C(CO2).C(H2) |
| C(CO).C(H2O) |
| C(CO2).C(H2) |
| C(CO).C(H2O) |
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
| K2 |
| K1 |
| K2 |
| K1 |
<
<
0(填写“>”或“<”或“=”)(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
CE
CE
(填写字母序号).A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度 F.恒压的条件下通入He气
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:
t2时
增大生成物浓度
增大生成物浓度
或升高温度
升高温度
;t8时增大压强
增大压强
或使用催化剂
使用催化剂
.②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率时间的关系线.
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如表所示:请回答:
(1)反应①是
(2)写出反应③的平衡常数K3的表达式
.
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
(用K1、K2表示).
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
查看习题详情和答案>>
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |
吸热
吸热
(填“吸热”或“放热”)反应.(2)写出反应③的平衡常数K3的表达式
| C(CO2).C(H2) |
| C(CO).C(H2) |
| C(CO2).C(H2) |
| C(CO).C(H2) |
(3)根据反应①与②可推导出K1、K2与K3之间的关系,则K3=
| K2 |
| K1 |
| K2 |
| K1 |
(4)要使反应③在一定条件下建立的平衡向逆反应方向移动,可采取的措施有
CE
CE
(填写字母序号).A.缩小反应容器的容积 B.扩大反应容器的容积 C.升高温度
D.使用合适的催化剂 E.设法减小平衡体系中的CO的浓度
(5)若反应③的逆反应速率与时间的关系如图所示:

①可见反应在t1、t3、t7时都达到了平衡,而t2、t8时都改变了一种条件,试判断改变的是什么条件:t2时
增大生成物浓度或升高温度
增大生成物浓度或升高温度
; t8时增大压强或使用催化剂
增大压强或使用催化剂
.②若t4时降压,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系线.
 由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:
由正丁醇(用n-C4H9OH表示)制备正溴丁烷(沸点:101.6℃)的反应如下:n-C4H9OH+NaBr+H2SO4→n-C4H9Br+NaHSO4+H2O
副反应:n-C4H9OH
| 浓H2SO4 |
| △ |
2n-C4H9OH
| ||
| △ |
3H2SO4(浓)+2NaBr(固)═2NaHSO4+Br2↑+SO2↑+2H2O
已知反应物及其用量:固体NaBr0.24mol,n-C4H9OH0.20mol,浓H2SO429mL,H2O20mL.
制备过程经历如下五个步骤,试回答下列问题:
1.投料:在圆底烧瓶中加入20mL水,再慢慢加入29mL浓硫酸,混合均匀并冷却至室温后,再依次加入0.20mol正丁醇(约18mL)和0.24mol溴化钠,充分振荡后加入几粒沸石.
(1)冷却至室温后再加正丁醇和溴化钠的目的是
A.减少HBr的挥发B.防止正丁醇的挥发
C.防止溴化钠被氧化D.防止温度过高导致炭化结焦
(2)本反应中硫酸与溴化作作用生成氢溴酸,氢溴酸与正丁醇作用发生取代反应生成正溴丁烷.硫酸的用量和浓度过大都对本制备不利的主要原因是
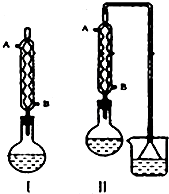
2.加热回流:反应装置选择Ⅱ而不选择Ⅰ的原因是
3.分离粗产物:反应结束待反应液冷却后,用直形冷凝管换下球形冷凝管,将其变为蒸馏装置进行蒸馏,得到的粗产物中除主产品外,还含下列选项中的
①C4H9OH ②SO2 ③(C4H9)2O ④Br2⑤NaHSO4 ⑥H2O ⑦H2SO4
4.洗涤粗产物:将馏出液移至分液漏斗中,加入等体积的水洗涤后,分液得有机层.如果不能判断哪层是有机层,可以用
5.收集产物:将干燥好的产物移至小蒸馏瓶中,加热蒸馏,收集99-103℃的馏分.要证明最终产物是n-C4H9Br,方法是