网址:http://m.1010jiajiao.com/timu3_id_51028[举报]
(1)如图,用铅蓄电池电解甲、乙两电解池中的溶液。已知铅蓄电池的总反应为Pb(s)+PbO2(s)+2H2SO4(aq)
 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 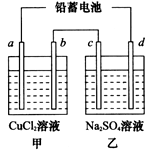
B.若利用甲池精炼铜,b极应为粗铜
C.放电时铅蓄电池负极的电极反应式为PbO2(s)+4H+(aq)+ SO42-(aq)+4e-=PbSO4(s)+2H2O(l)
D.若四个电极材料均为石墨,当析出6.4gCu时,两池中共产生气体3.36L(标准状况下)
(2)某二元酸H2A在水中的电离方程式是H2A=H++ HA-:HA-
 H++A2-。
H++A2-。 ①Na2A溶液显_______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示);
②已知0.1mol/L的NaHA溶液的pH=2,则0.1mol/L 的H2A溶液中氢离子的物质的量浓度可能____________(填“大于” “小于”或“等于”)0.11mol/L,理由是________________
(3)二甲醚是一种重要的清洁燃料,利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)
 CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol ②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol ③CO(g)+H2O(g)
 CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol 写出水煤气直接合成二甲醚同时生成CO2的热化学反应方程式:___________________。
(4)SO2是硫酸生产中的重要中间产物,也是空气污染的主要原因之一,其被氧化生成SO3的反应为2SO2(g)+O2(g)
 2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。 (13分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
查看习题详情和答案>>
(13分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+浓度下降,这样,恰好完全反应时NH4+浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
(13分)某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。

写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
查看习题详情和答案>>
某学习小组甲利用中和反应原理和DIS系统(即数字化信息系统,由传感器、数据采集器和计算机组成)测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点。请回答:
(1)实验时量取10.00mL氨水样品,配制成100mL待测氨水,则该步操作中需要的仪器有_________________(填仪器名称)。
(2)量取20.00mL上述溶液倒入洁净干燥锥形瓶中,连接好DIS系统。如果锥形瓶中含有少量蒸馏水,是否会影响测量结果_______(填“是”“否”“不能确定”)。
 (3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
(3)①滴定管盛放盐酸前,要先__________________,用少量蒸馏水洗涤后,再_________________,然后加入盐酸调整液面至凹液面的最低点处于滴定管的_________________。
②向锥形瓶中滴加0.10mol·L-1的盐酸,计算机屏幕上显示出溶液导电能力与加入盐酸体积关系的曲线图。
写出氨水与盐酸反应的离子方程式___________________________;该氨水样品的物质的量浓度为_____________。
(4)另一学习小组乙认为上述测量结果仍存在一定误差,因为生成的NH4Cl 是强酸弱碱盐,会发生水解而使NH4+ 浓度下降,这样,恰好完全反应时NH4+ 浓度不是最大值,溶液导电性就不是最大值。你认为乙学习小组的结论是否正确?________,理由是___________________。
查看习题详情和答案>>