摘要:离子化合物的电子式表示方法: 在离子化合物的形成过程中.活泼的金属离子失去电子变成金属阳离子.活泼的非金属离子得到电子变成非金属阴离子.然后阴阳离子通过静电作用结合成离子键.形成离子化合物.所以.在离子化合物的电子式中由阳离子和带中括号的阴离子组成且简单的阳离子不带最外层电子.而阴离子要标明最外层电子多少. 如:
网址:http://m.1010jiajiao.com/timu3_id_50579[举报]
 离子反应是中学化学中重要的反应类型.回答下列问题:
离子反应是中学化学中重要的反应类型.回答下列问题:(1)在发生离子反应的反应物或生成物中,一定存在有
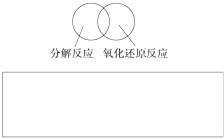
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示如图.请在方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.
(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为H++OH-═H2O | |
| ③离子方程式中凡是难溶性酸、碱、盐均要标“↓”符号 |
2- 4 |
①
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有______
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示如图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)写出能用CO32-+2H+=CO2↑+H2O表示的化学方程式______.写出不能用H++OH-=H2O表示的中和反应的化学方程式______.
查看习题详情和答案>>
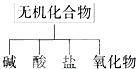
无机化合物可根据其组成和性质进行分类:
(1)上述所示的物质分类方法名称是
(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
(3)写出⑦转化为⑤的化学方程式
(4)写出①与③反应的离子方程式
(5)写出②与⑤反应的离子方程式
(6)写出①与Zn反应的化学方程式(用双线桥法标出电子转移方向和数目)
 ;氧化剂是
;氧化剂是
查看习题详情和答案>>

(1)上述所示的物质分类方法名称是
树状分类法
树状分类法
.(2)以Na、K、H、O、S、N中任两种或三种元素组成合适的物质,分别填在下表中②③⑥后面.(各空填写一个化学式即可)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ② H2SO4 H2SO4 |
③ NaOH NaOH ④Ba(OH)2 |
⑤Na2CO3 ⑥ K2SO4 K2SO4 |
⑦CO2 ⑧Na2O |
⑨NH3 ⑩H2O |
CO2+2NaOH═Na2CO3+H2O
CO2+2NaOH═Na2CO3+H2O
(4)写出①与③反应的离子方程式
H++OH-═H2O
H++OH-═H2O
(5)写出②与⑤反应的离子方程式
2H++CO32-═CO2↑+H2O
2H++CO32-═CO2↑+H2O
(6)写出①与Zn反应的化学方程式(用双线桥法标出电子转移方向和数目)


HCl
HCl
还原剂是Zn
Zn
. 无机化合物可根据其组成和性质进行分类:
无机化合物可根据其组成和性质进行分类:(1)如图所示的物质分类方法名称是
树状分类法
树状分类法
;(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,将化学式分别填在下表②④⑥的后面;(只需填一种)
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 |
| 化学式 | ①HCl ② H2SO4 H2SO4 |
③Ba(OH)2 ④ NaOH NaOH |
⑤Na2CO3 ⑥ K2SO4 K2SO4 |
⑦CO2 ⑧Na2O2 |
Ba(OH)2=Ba2++2OH-
Ba(OH)2=Ba2++2OH-
;(4)写出①和⑤反应的离子方程式
CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
. 含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.已知:
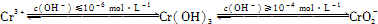
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去.
①写出Cr2O
2- 7 |
②用离子方程式表示溶液pH不能超过10的原因:
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O
2- 7 |
①写出阴极的电极反应式:
②电解法中加入氯化钠的作用是
(3)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
①CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若该过程中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的化学方程式为
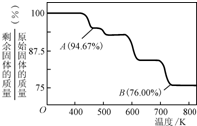
②CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示,则B点时剩余固体的成分是