网址:http://m.1010jiajiao.com/timu3_id_49302[举报]
(1)夏天的食品容易霉变,冬天就不容易发生该现象
(2)熔化的氯酸钾放出气泡很慢,撒入少量二氧化锰很快产生气体
(3)工业上常将固体燃料粉碎,以提高燃烧效率
(4)集气瓶中H2和Cl2的混合气体,在瓶外点燃镁条时发生爆炸
 已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:
已知ClO4F的熔点为-167℃,沸点为-15.9℃,易分解或接触有机物发生爆炸;又知无水KF易吸收F2、HF和H2O;F2、HF、O2的沸点分别为-188℃、19.54℃、-183℃.李明采用特制的耐氟容器,使氟气缓缓地与一定浓度的HClO4反应来制取ClO4F,其实验装置如图所示,试回答:(1)实验中生成X的化学方程式是
(2)现有10%和30%的HClO4,李明最好选用
(3)B中冷却剂选用液氧的理由是
(4)A中填充环状物的作用是
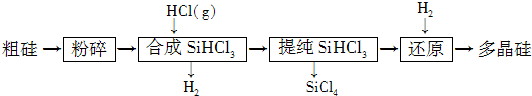
(1)粗硅粉碎的目的是
(2)900℃以上,H2与SiHCl3发生如下反应:SiHCl3(g)+H2(g)?Si(s)+3HCl(g);△H>0,其平衡常数表达式为K=
| c3(HCl) |
| c(SiHCl)×c(H2) |
| c3(HCl) |
| c(SiHCl)×c(H2) |
(3)该流程中可以循环使用的物质是
(4)SiCl4与上述流程中的单质发生化合反应,可以制得SiHCl3,其化学方程式为
某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
该反应的离子方程式为________________________________________________。
提出合理假设。该实验中反应速率明显加快的原因可能是__________。
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
(20分)某合作小组同学将铜片加入稀硝酸,发现开始时反应非常慢,一段时间后反应速率明显加快。该小组通过实验探究其原因。
(1)该反应的离子方程式为___________________________________________________。
(2)提出合理假设。该实验中反应速率明显加快的原因可能是_____________________。
A.反应放热导致温度升高 B.压强增大
C.生成物的催化作用 D.反应物接触面积增大
(3)初步探究。测定反应过程中溶液不同时间的温度,结果如下表:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
结合实验目的和表中数据,你得出的结论是__________________________________。
(4)进一步探究。查阅文献了解到化学反应的产物(含中间产物)可能对反应有催化作用,请完成以下实验设计表并将实验目的补充完整:
| 实验 编号 | 铜片 质量/g | 0.1mol·L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 |
|
| 实验①和②探究_________的影响;实验①和③探究亚硝酸根的影响。 |
| ② |
|
| 0.5 |
| |
| ③ |
|
|
|
|
查看习题详情和答案>>