网址:http://m.1010jiajiao.com/timu3_id_49292[举报]
(8分)【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下: 
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4易溶于下列 。
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
【化学—物质结构与性质】
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)Cr的核外电子排布式为 ;
(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:
图中虚线表示的作用力为 ;
(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4·H2O晶体。在Cu(NH3)4SO4·H2O晶体中,[Cu(NH3)4]2+ 为平面正方形结构,则呈正四面体结构的原子团是 ,其中心原子的杂化轨道类型是 ;
(4)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型。试推测四羰基镍的晶体类型是 , Ni(CO)4 易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
查看习题详情和答案>>Q、X、W、Y、Z都是元素周期表中前36号的元素,其中X、W同周期,Q、W同主族,已知:
①电负性Q>W;X、Y原子的价层电子构型为nS1,其电离能数据如下:
| X | Y | |
| 第一电离能(KJ/mol) | 495.8 | 418.8 |
回答下列问题:
(1)写出Q元素原子的轨道表示式为
(2)比较XW、YW的熔点高低并说明理由.
(3)写出Z的价层电子排布式
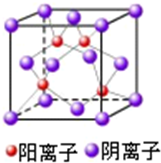
(4)ZW的晶胞结构如图所示,阴离子周围最近的阳离子有
(5)Q的气态氢化物在25℃、80℃及90℃(均在常压下),测得其摩尔质量分别为58.0g/mol、20.6g/mol、20.0g/mol.在不同温度下摩尔质量不同的可能原因