摘要: (1) MnSO4 (2)增大溶液的pH.使Fe3+和 Al3+生成沉淀, 使形成胶体的氢氧化铝和氢氧化铁也生成沉淀, H2SO4 (3) Fe2O3.Al2O3.S (4)纯碱 .H2SO4 降温结晶
网址:http://m.1010jiajiao.com/timu3_id_48345[举报]
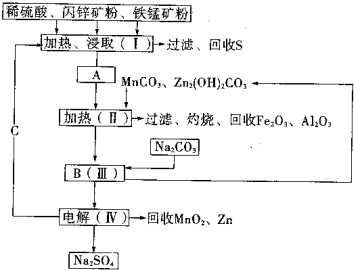 (2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
(2011?湖南模拟)某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是
MnSO4
MnSO4
.(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是
增大溶液的PH,使Fe3+和Al3+均生成沉淀
增大溶液的PH,使Fe3+和Al3+均生成沉淀
;Ⅱ需要加热的原因是
促进Fe3+和Al3+的水解
促进Fe3+和Al3+的水解
;C的化学式是H2SO4
H2SO4
.(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是
Fe2O3、Al2O3、S、Na2SO4
Fe2O3、Al2O3、S、Na2SO4
.(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是
纯碱和硫酸
纯碱和硫酸
.(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是
1.03
1.03
.菱锰矿的主要成分是碳酸锰,还含有Fe2O3、FeO、CaO、MgO等成分.某化工厂用废盐酸(质量分数约为20%)与菱锰矿制备MnCl2.4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水),部分工艺流程如图1:
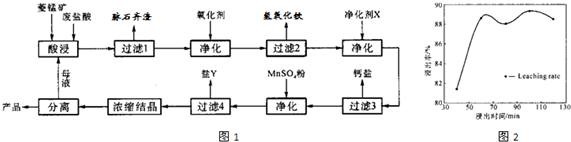
(1)盐酸与菱锰矿中碳酸锰反应的化学方程式为
(2)酸浸取时,浸出时间对浸出率的影响如图2所示,工业采用的浸取时间是60min,其可能的原因是
(3)图1中“净化剂X”可能是
(4)加入MnSO4后控制实验条件析出某种杂质离子的盐Y,盐Y的主要成分是
(5)浓缩结晶时,必须一出现晶膜就立刻停止加热,其原因是
查看习题详情和答案>>

(1)盐酸与菱锰矿中碳酸锰反应的化学方程式为
MnCO3+2HCl=MnCl2+CO2↑+H2O
MnCO3+2HCl=MnCl2+CO2↑+H2O
(2)酸浸取时,浸出时间对浸出率的影响如图2所示,工业采用的浸取时间是60min,其可能的原因是
浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理
浸取时间为60分钟时浸取率出现第一个峰值,此后时间延长对浸出率没有明显影响.从提高生产效率角度考虑再延长浸出时,浸出的增量不明显,而且还会增大生产成本,选择浸出时间为60分钟较为合理
.(3)图1中“净化剂X”可能是
MnCO3
MnCO3
.(4)加入MnSO4后控制实验条件析出某种杂质离子的盐Y,盐Y的主要成分是
MgSO4
MgSO4
.(5)浓缩结晶时,必须一出现晶膜就立刻停止加热,其原因是
若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯
若水分太少可能导致得到的晶体是失去部分结晶水的产物,导致产品不纯
.科研人员将软锰矿(MnO2含量≥65%,SiO2含量约20%,A12O3含量约4%,其余为水分)和闪锌矿(ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分)同槽酸浸开发出综合利用这两种资源的新工艺,如图所示为工艺流程的一部分.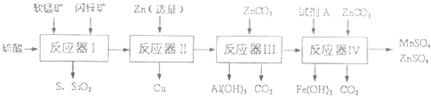
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
请回答:
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+
(2)反应器II中发生反应的离子方程式为
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因
(4)反应器中IV中,试剂A可以是下列物质中
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为
查看习题详情和答案>>

已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+
MnO2
MnO2
+H2SO4→S↓
S↓
+MnSO4
MnSO4
+CuSO4+H2O(2)反应器II中发生反应的离子方程式为
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
Zn+2Fe3+=2Fe2++Zn2+、Zn+Cu2+=Cu+Zn2+
.(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
ZnCO3与溶液中的H+反应,导致溶液中c(H+)减小,c(OH-)增大,c(Al3+)?c(OH-)>Ksp[Al(OH)3],
.检验ZnCO3是否过量的操作方法是取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
取少许沉淀于试管中,滴加适量的稀硫酸,若有气泡产生,则说明ZnCO3过量;若无气泡产生,则说明ZnCO3不过量
.(4)反应器中IV中,试剂A可以是下列物质中
c
c
(填代号).a.氨水 b.氢氧化钠 c.MnO2 d.稀硫酸(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为
8.0≤pH<8.3
8.0≤pH<8.3
,要将分离出沉淀后的滤液进行浓缩,需将温度控制在90℃~100℃,可采用的加热方法是水浴加热
水浴加热
.(2011?奉贤区一模)苯甲醛在医药、染料、香料等工业有广泛的应用.实验室通过如图所示的操作流程可制备苯甲醛:
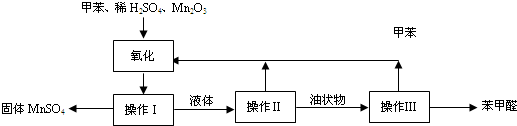
试回答下列问题:
(1)此反应中氧化剂是
(2)操作I需经三步才能完成:第一步为冷却结晶,第二步为
(3)操作II的名称为
(4)操作Ⅲ的原理是
(5)实验过程中,可以循环使用的物质是
(6)实验中发现,反应时间不同,苯甲醛的产率也不同(数据见表)
请结合苯甲醛的结构特点,分析当反应时间过长时,其产率下降的原因:
查看习题详情和答案>>

试回答下列问题:
(1)此反应中氧化剂是
Mn2O3
Mn2O3
,稀硫酸的作用是形成酸性环境或增大Mn2O3的氧化性
形成酸性环境或增大Mn2O3的氧化性
.(2)操作I需经三步才能完成:第一步为冷却结晶,第二步为
过滤
过滤
,第三步为洗涤;其中冷却的目的是降低MnSO4的溶解度
降低MnSO4的溶解度
;第二步需用到的玻璃仪器为漏斗、玻璃棒、烧杯
漏斗、玻璃棒、烧杯
.(3)操作II的名称为
分液
分液
,该操作主要适用于分离两种互不相溶的液体
分离两种互不相溶的液体
.(4)操作Ⅲ的原理是
利用被分离物质的沸点不同,通过加热冷凝达到分离目的
利用被分离物质的沸点不同,通过加热冷凝达到分离目的
.(5)实验过程中,可以循环使用的物质是
稀硫酸、甲苯
稀硫酸、甲苯
.(6)实验中发现,反应时间不同,苯甲醛的产率也不同(数据见表)
| 反应时间(h) | 1 | 2 | 3 | 4 | 5 |
| 苯甲醛产率(%) | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
随着时间的延长,苯甲醛有部分被氧化成苯甲酸
随着时间的延长,苯甲醛有部分被氧化成苯甲酸
.【实验名称】对草酸溶液中逐滴加入高锰酸钾溶液反应的速率变化的探究.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入高锰酸钾溶液时,溶液褪色总是先慢后快.即反应速率由小变大.为此,甲同学做了如下实验进行探究:(已知:
①MnO4-在酸性环境下的还原产物是Mn2+ ②2KClO3
2KCl+3O2↑,2KMnO4
K2MnO4+MnO2+O2↑)
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
试剂:草酸晶体( H2C2O4?2H2O、0.01mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L
KMnO4溶液和几滴稀硫酸.现做如下对比实验,现象如下表所示:
请回答下列问题:
①甲同学进行该实验还缺少的实验仪器是:
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:
③甲同学测出的褪色时间是以下列哪个选项为依据的
A、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I
查看习题详情和答案>>
①MnO4-在酸性环境下的还原产物是Mn2+ ②2KClO3
| ||
| △ |
| ||
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
试剂:草酸晶体( H2C2O4?2H2O、0.01mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体
1.3
1.3
g(精确到0.1g);实验中需要用到的玻璃仪器有:玻璃棒、烧杯、胶头滴管和100mL容量瓶
100mL容量瓶
.(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L
KMnO4溶液和几滴稀硫酸.现做如下对比实验,现象如下表所示:
| 加入药品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 |
加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 实验现象 (褪色时间)/s |
H2C2O4褪色很慢 (31秒) |
H2C2O4褪色很快(4秒) |
①甲同学进行该实验还缺少的实验仪器是:
秒表
秒表
.②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
.③甲同学测出的褪色时间是以下列哪个选项为依据的
C
C
.A、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是
锰离子在反应中起到催化剂的作用,加快了反应速率
锰离子在反应中起到催化剂的作用,加快了反应速率
.于是甲同学得出结论在其它条件不变的情况下,加入催化剂可加快化学反应速率
在其它条件不变的情况下,加入催化剂可加快化学反应速率
.(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I
该反应是放热反应,温度升高,反应速率增大,溶液褪色加快
该反应是放热反应,温度升高,反应速率增大,溶液褪色加快
,II硫酸的浓度影响反应速率,加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应
硫酸的浓度影响反应速率,加入少量硫酸,可以促进草酸和高锰酸钾溶液的反应
.