网址:http://m.1010jiajiao.com/timu3_id_48316[举报]
实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)【提出问题】Fe3+、Br2谁的氧化性更强?
(2)【猜想】①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__________(填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含__________所致。
(3)【设计实验并验证】
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)【应用与拓展】
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色,所发生的离子方程式为______________________________。
②在100 mL FeBr2溶液中通入2.24 L Cl2(标准状况),溶液中有1/3的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为__________。
查看习题详情和答案>>(13分)Fe.Cu都是人类最早使用的金属。某校化学研究性学习小组的同学运用实验手段研究Fe.Cu的相关性质,请你参与研究并完成下列各题:
(1)甲同学取一束细铜丝用砂纸打磨后放在酒精灯上加热至红热,然后迅速伸入盛Cl2的集气瓶中。你认为甲同学在实验中应该观察到的现象是 。
(2)乙同学为探究Fe在冷浓HNO3和热浓HNO3中的反应情况,设计了如图所示的实验装置:

乙同学发现装置1中Fe未溶解,其原因是 ;装置2生成的气体(假定为NO2和NO混合气体)全部通入100mL 4mol/L NaOH溶液,恰好被完全吸收,反应为:
NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
若生成NaNO3和NaNO2物质的量之比为1:3,则混合气体中NO2和NO的体积比为 。
(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片先逐渐溶解,反应一段时间后不再溶解。
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应。他依据的反应现象是 。
②丁同学认为丙同学的结论不完全正确,他的理由是 。
(4)请你设计实验证明某溶液中只含Fe2+而不含Fe3+。说明具体实验操作和实验现象:
。
查看习题详情和答案>>实验探究题
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:![]() 、
、![]() 谁的氧化性更强?
谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:![]() >
>![]() ,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含__(填化学式,下同)所致。
②乙同学认为氧化性:![]() >
> ![]() ,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
,故上述实验现象是发生化学反应所致,则溶液呈黄色是含_▲_所致。
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a. 酚酞试液 b. 四氯化碳 c. 无水酒精 d. 硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | ||
| 方案2 |
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为_▲_。
②在100![]() 溶液中通入
溶液中通入![]() (标准状况),溶液中有1/3的Br-被氧化成单质
(标准状况),溶液中有1/3的Br-被氧化成单质![]() ,则原
,则原![]() 溶液中
溶液中![]() 的物质的量浓度为_▲_。
的物质的量浓度为_▲_。
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)
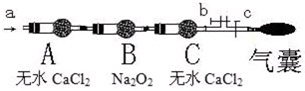
①先打开b关闭c,通入
A.空气 B.O2C.CO2 D.N2
②然后
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式:
查阅资料:Cu2O 溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
(1)假设3:
设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN 溶液.
(2)若假设1成立,则实验现象是
(3)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁.你认为这种说法合理吗?
(4)若固体粉末完全溶解无固体存在,滴加 KSCN 试剂时溶液不变红色,则证明原固体粉末是
探究延伸:经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物.
(5)实验小组欲用加热法测定Cu2O的质量分数.取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为
| 9(b-a) |
| a |
| 9(b-a) |
| a |