摘要:26.BC (2分,若只选一个且选对的得1分,全对得2分) (2)循环过程需要很高的能量.且使用重金属汞.会产生污染. (3) SO2+I2+2H2O2HI+H2SO4 SO2和I2可循环使用.无污染. (4)不现实.理由是现有的制取氢气方法耗能大.制取的成本太高,另外是氢气的熔沸点太低.给储存和运输带来困难. (或:现实.制取氢气用水为原料.来源丰富,氢气燃烧的产物是水.不会给环境带来任何污染等)
网址:http://m.1010jiajiao.com/timu3_id_48301[举报]
(2012?南京模拟)“氢能”将是未来最理想的新能源.
(1)实验测得,1g H2(g)燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
CaO+2HBr ②2HBr+Hg
HgBr2+H2
③HgBr2+
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式
根据“绿色化学”的思想评估该方法制H2的主要缺点
(3)氢气通常用生产水煤气的方法制得.其中:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
②850℃时,若向一容积可变的密闭容器中同时充入 1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
(4)工业生产中,常用氢氧化钠溶液吸收排放废气中的二氧化硫,并将吸收产物电解,可以产生氢气、
硫酸等物质,装置如图1所示.该电解过程中阳极的电极反应式为
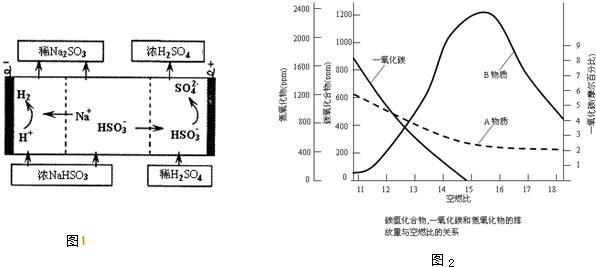
(5)一氧化碳、氮氧化物和碳氢化合物是汽车尾气的主要成分.已知空燃比(空气、燃料体积之比)与尾气中各成分排放量关系如图2所示.B物质的名称是
查看习题详情和答案>>
(1)实验测得,1g H2(g)燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ/mol
.(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
| ||
| ||
③HgBr2+
CaO
CaO
| ||
HgO
HgO
+CaBr2
CaBr2
④2HgO
| ||
请你根据“原子经济”的思想完成上述步骤③的化学方程式
HgBr2+CaO
HgO+CaBr2
| ||
HgBr2+CaO
HgO+CaBr2
.
| ||
根据“绿色化学”的思想评估该方法制H2的主要缺点
循环过程需要很高的能量,且使用重金属汞,产生污染
循环过程需要很高的能量,且使用重金属汞,产生污染
.(3)氢气通常用生产水煤气的方法制得.其中:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K
小于
小于
1(填“大于”、“小于”或“等于”).②850℃时,若向一容积可变的密闭容器中同时充入 1.0mol CO、3.0mol H2O、1.0mol CO2 和x mol H2,若要使上述反应开始时向正反应方向进行,则x应满足的条件是
0≤x<3
0≤x<3
.(4)工业生产中,常用氢氧化钠溶液吸收排放废气中的二氧化硫,并将吸收产物电解,可以产生氢气、
硫酸等物质,装置如图1所示.该电解过程中阳极的电极反应式为
HSO3-+H2O-2e-=SO42-+3H+
HSO3-+H2O-2e-=SO42-+3H+
.
(5)一氧化碳、氮氧化物和碳氢化合物是汽车尾气的主要成分.已知空燃比(空气、燃料体积之比)与尾气中各成分排放量关系如图2所示.B物质的名称是
氮氧化物
氮氧化物
.科学家预测“氢能”将是未来21世纪最理想的新能源.利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为:2H2O
2H2+O2,其循环过程分三步进行:
(a) SO2+I2+H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O,下列分析不合理的是( )
| SO2/I2 |
(a) SO2+I2+H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O,下列分析不合理的是( )
查看习题详情和答案>>
科学家预测“氢能”将是未来21世纪最理想的新能源.利用硫-碘热循环法制取氢也是化学家常用的一种方法,总反应方程式为:2H2O
2H2+O2,其循环过程分三步进行:
(a) SO2+I2+H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O,下列分析不合理的是( )
查看习题详情和答案>>
| SO2/I2 |
(a) SO2+I2+H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O,下列分析不合理的是( )
| A.由于硫酸很稳定,所以反应(c)最难进行 |
| B.该循环过程不需要很高的热能,即就是在较低温度下才能进行 |
| C.生成的SO2和I2可以循环使用,其它产物对环境无污染 |
| D.该过程耗能太大,把太阳能用到上述循环中,该工艺将是合理的 |
 2H2+O2,其循环过程分三步进行:
2H2+O2,其循环过程分三步进行: