摘要:某学生两次分别用2.6 g锌和硝酸溶液进行反应.两次所用的硝酸溶液中均含有6.3 g HNO3.但浓度不同.均恰好完全反应.又已知第一次实验中有1/5的HNO3被还原.第二次实验中只有1/10的HNO3被还原.试写出相应的化学方程式: 第一次实验: 第二次实验:
网址:http://m.1010jiajiao.com/timu3_id_47689[举报]
某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式___________________________
_______________________________________________________________________________。
查看习题详情和答案>>
某学生两次分别用2.6 g锌与硝酸溶液进行反应,两次所用的硝酸溶液中均含有6.3 g的HNO3,但浓度不同,均恰好完全反应。又已知第一次实验中有1/5的HNO3被还原,第二次实验中只有1/10的HNO3被还原。试写出相应的反应方程式_______________________________。
查看习题详情和答案>>
某研究小组利用题下图装置探究温度对CO还原Fe2O3的影响(固定装置略)

(1)MgCO3的分解产物为 .
(2)装置C的作用是 ,处理尾气的方法为 .
(3)将研究小组分为两组,按题上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物).两组分别用产物进行以下实验:
①乙组得到的黑色粉末是 .
②甲组步骤1中反应的离子方程式为 .
③乙组步骤4中,溶液变红的原因为 ,溶液褪色可能的原因及其验证方法为 .
④从实验安全考虑,题上图装置可采取的改进措施是 .
查看习题详情和答案>>

(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按题上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物).两组分别用产物进行以下实验:
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 取步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变红的原因为
④从实验安全考虑,题上图装置可采取的改进措施是
(2013?重庆)某研究小组利用题9图装置探究温度对CO还原Fe2O3的影响(固定装置略)
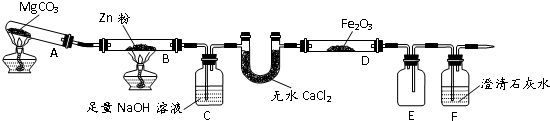
(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
①乙组得到的黑色粉末是
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变红的原因为
④从实验安全考虑,题9图装置还可采取的改进措施是
查看习题详情和答案>>

(1)MgCO3的分解产物为
MgO、CO2
MgO、CO2
.(2)装置C的作用是
除CO2
除CO2
,处理尾气的方法为点燃
点燃
.(3)将研究小组分为两组,按题9图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验.
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
Fe
Fe
.②甲组步骤1中反应的离子方程式为
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4+8H+=Fe2++2Fe3++4H2O
.③乙组步骤4中,溶液变红的原因为
Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色
Fe2+被氧化为Fe3+,Fe3+遇SCN-显红色
;溶液褪色可能的原因及其验证方法为假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立
假设SCN-被Cl2氧化,向溶液中加入KSCN溶液,若出现红色,则假设成立
.④从实验安全考虑,题9图装置还可采取的改进措施是
在装置B、C之间添加装置E,以防倒吸
在装置B、C之间添加装置E,以防倒吸
.配制0.25mol?L-1的NaOH溶液100mL,某学生操作如下:
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸.
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线.
③写出一个标有配制日期的“0.25mol?L-1NaOH溶液”的标签,贴在容量瓶上密闭保存.指出上述操作中的7处错误:
(1)
(3)
(5)
(7)
查看习题详情和答案>>
①用托盘天平称出1.00g氢氧化钠:将天平调好零点,再在两盘上各取一张同样质量的纸,把游码调到1.00g的位置上,于左盘放粒状氢氧化钠至天平平衡,取下称好的氢氧化钠,并撤掉两盘上的纸.
②把称好的氢氧化钠放入一只100mL的烧杯中,加入约10mL水,搅拌使之溶解,溶解后立即用玻璃棒引流将溶液移至一只100mL的容量瓶内,加水至离刻度线约2cm处,用滴管加水至刻度线.
③写出一个标有配制日期的“0.25mol?L-1NaOH溶液”的标签,贴在容量瓶上密闭保存.指出上述操作中的7处错误:
(1)
NaOH应放在干燥的烧杯中称量
NaOH应放在干燥的烧杯中称量
;(2)用过的游码未拨回原处
用过的游码未拨回原处
(3)
托盘天平只能称出0.1g,称不出1.00 g
托盘天平只能称出0.1g,称不出1.00 g
;(4)烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶
烧杯和玻璃棒未洗涤,洗涤液亦应转入容量瓶
(5)
溶解NaOH应冷却后再转移至容量瓶中
溶解NaOH应冷却后再转移至容量瓶中
;(6)容量瓶中的溶液未摇匀
容量瓶中的溶液未摇匀
(7)
配好的溶液应及时转移到有胶塞的试剂瓶内
配好的溶液应及时转移到有胶塞的试剂瓶内
.