摘要: (1) n(H2O) = (2) n(C2O42-) = 0.0500 mol·L-1×0.024 L× m(C2O42-) = 0.003 mol ×88 g·mol-1 = 0.264g ω(C2O42-) =×100% = 53.8 % (3) 因为n(Fe3+) = n(Fe2+) = 0.0500 mol·L-1×0.004 L×5 = 0.00100 mol 1 :y :z = 0.00100 mol :0.00300 mol :0.00300 mol = 1 :3 :3 则 y = 3 . z = 3 根据电荷平衡有:x + 3 = 2y.得x = 3 所以.化合物的化学式为:K3Fe(C2O4)3·3H2O
网址:http://m.1010jiajiao.com/timu3_id_47065[举报]
(2012?石家庄二模)氨是重要的化工产品之一,研究合成氨反应具有重要意义.σ
(1)已知断裂下列化学键需要吸收的能量分别为:N≡N 946.0kJ?mol-1、H-H 436kJ?mol-1、N-H 390.8kJ?mol-1,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式
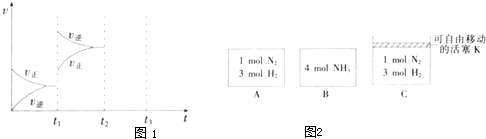
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如图1所示:
①t1时刻改变的条件为
②t2时刻,恒压充入氦气,t3时刻达到平衡.在图中画出t2时刻后的速率变化图象.
(3)相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图2所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.
①达到平衡时,A、C两个容器中NH3的浓度分别为c1、c2,则c1
②达到平衡时,若A、B两容器中反应物的转化率分别为α(A)、α(B),则 α(A)+α(B)
③达到平衡时,若容器C的体积是起始时的
,则平衡时容器C中H2的体积分数为
(4)直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2═2N2+6H2O,则负极的电极反应式为
查看习题详情和答案>>

(1)已知断裂下列化学键需要吸收的能量分别为:N≡N 946.0kJ?mol-1、H-H 436kJ?mol-1、N-H 390.8kJ?mol-1,写出以N2(g)和H2(g)为原料合成NH3(g)的热化学方程式
N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ?mol-1
N2(g)+3H2(g)?2NH3(g)△H=-90.8 kJ?mol-1
(2)某小组研究了其他条件不变时,改变某一条件对上述反应的影响,实验结果如图1所示:
①t1时刻改变的条件为
升高温度
升高温度
.②t2时刻,恒压充入氦气,t3时刻达到平衡.在图中画出t2时刻后的速率变化图象.
(3)相同温度下,A、B、C三个密闭容器,A、B恒容,C带有可自由移动的活塞K,各向其中充入如图2所示反应物,初始时控制活塞K,使三者体积相等,一段时间后均达到平衡.
①达到平衡时,A、C两个容器中NH3的浓度分别为c1、c2,则c1
<
<
c2(填“>”、“<”或“=”).②达到平衡时,若A、B两容器中反应物的转化率分别为α(A)、α(B),则 α(A)+α(B)
<
<
1(填“>”、“<”或“=”).③达到平衡时,若容器C的体积是起始时的
| 3 | 4 |
50%
50%
(4)直接供氨式碱性燃料电池(DAFC),以KOH溶液为电解质溶液,其电池反应为 4NH3+3O2═2N2+6H2O,则负极的电极反应式为
2NH3-6e-+6OH-═N2+6H2O
2NH3-6e-+6OH-═N2+6H2O
. 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ?mol | 243 | 436 | 431 | 946 |
a 2HCl(g)=H2(g)+Cl2(g);△H=
+183kJ/mol
+183kJ/mol
b N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol,则N-H键的键能是
391
391
kJ?mol(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
NO2(g)+CO(g)=CO2(g)+NO(g)
NO2(g)+CO(g)=CO2(g)+NO(g)
△H=-234kJ?mol-1
△H=-234kJ?mol-1
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1
②2CO (g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3
则CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
(4)已知:2Al (s)+
| 3 |
| 2 |
2Fe (s)+
| 3 |
| 2 |
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程式
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1
.(2013?乐山三模)下列各项中,理由、结论及因果关系均正确的是( )
|
查看习题详情和答案>>
(1)1799年,意大利物理学家伏特制成了世界上第一个电池-“伏打”电池,直接促进了人类文明的发展.下列①~⑤装置中,能构成原电池的是

(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
工业合成氨的反应是
查看习题详情和答案>>
①
①
(填序号),其正极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,负极反应式为Zn-2e-=Zn 2+
Zn-2e-=Zn 2+
,电子向正极
正极
(填“正极”或“负极”,下同)运动,H+向正极
正极
运动.
(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
N2(g)+3H2(g)
2NH3(g)
| ||
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)
.
| ||
| 高温高压 |
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
放热
放热
(填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为92
92
kJ.