摘要:23.答案:(1)0.03 (2)①0.5 大于 该反应正反应为放热反应.化学平衡常数随温度的升高而减小 ② 向左 b (3)小于 解析:(1)0-4min CO的平均反应速率为: v mol·L-1/4 min=0.03 mol·L-1·min-1 (2)t1℃时3min-4min为平衡状态.该反应的平衡常数为: K(t1℃)={[CO2]·[H2]}/{[CO]·[H2O]}=/=0.5 由左图知:850℃时.CO.H2O.CO2.H2的平衡浓度分别为:0.08 mol·L-1.0.18 mol·L-1=0.12 mol·L-1. mol·L-1=0.12 mol·L-1.0.12 mol·L-1.平衡常数为K/=1.K(t1℃)<K.故t1℃大于850℃.因为该反应正反应为放热反应.化学平衡常数随温度的升高而减小. 由右上表知:反应在4min-5min间.CO(g)和H2O(g)的浓度增大.CO2的浓度减小.只能是增加了H2的浓度.平衡向左移动. (3)850℃时.CO2(g)十H2 (g)CO(g)十H2O(g)与原反应互为可逆反应.其平衡常数为K也为1.t2℃时.由[CO2]·[H2]=2[CO]·[H2O]得.该温度下的平衡常数为:K(t2℃)={[CO]·[H2O]}/{[CO2]·[H2]}=1/2<1.故t2℃<850℃.
网址:http://m.1010jiajiao.com/timu3_id_44998[举报]
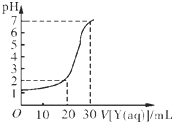 某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用NaOH标准溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:(a)取碱式滴定管;(b)用蒸馏水洗净;(c)即加入NaOH标准溶液;(d)记录液面刻度读数;(e)用酸式滴定管精确放出一定量待测盐酸溶液于只用蒸馏水洗涤过的锥形瓶中;(f)向锥形瓶中加入适量蒸馏水;(g)加入酚酞试液2滴;(h)滴定时边摇荡锥形瓶;(i)边注视滴定管内液面变化;(j)当滴到溶液由无色恰好变为粉红色时,立即停止滴定;(k)记录液面刻度读数;(m)重复两次滴定并记录读数
(1)上述实验过程中错误之处有(用序号字母填写)
cij
cij
(2)如下图所示,某同学绘制了用标准NaOH溶液(Y)滴定10.00mL待测盐酸溶液(X)过程中的滴定曲线,依据图象推出X和Y的物质的量浓度是下表中的
A
A
.| A | B | C | D | |
| X/mol?L-1 | 0.09 | 0.03 | 0.9 | 0.3 |
| Y/mol?L-1 | 0.03 | 0.09 | 0.3 | 0.9 |
ADE
ADE
.A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
(2010?杭州一模)海水中含有多种盐类物质,在一定温度下将海水不断浓缩,其间会不断有晶体析出,且海水的密度逐渐增大,下表为一定温度下不同密度的海水中几种盐类的含量(g/mL)
回答下列问题:
(1)在该温度下恒温蒸发海水时,海水的密度从1.13g/mL增大到1.21g/mL时是否有硫酸钙析出?
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
查看习题详情和答案>>
| 海水密度(g/mL) | CaSO4 (g/L) |
NaCl (g/L) |
MgCl2 (g/L) |
MgSO4 (g/L) |
NaBr (g/L) |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |
(1)在该温度下恒温蒸发海水时,海水的密度从1.13g/mL增大到1.21g/mL时是否有硫酸钙析出?
是
是
(2)恒温下,当蒸发1m3密度为1.22g/mL的海水达到密度为1.26g/mL时,析出MgSO4的质量为
0.03
0.03
kg,析出NaCl的质量为8.33
8.33
kg.汽车尾气中的主要污染物是NO以及燃料不完全燃烧所产生的CO.为了减轻大气污染,人们提出通过以下反应来处理汽车尾气:
2NO(g)+2CO(g)
2CO2(g)+N2(g)△H=a kJ?mol-1.
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如表1(CO2和N2的起始浓度为0).
表1
回答下列问题:
(1)在上述条件下该反应能自发进行,则正反应必然是 反应(填“放热”或“吸热”).
(2)前3s内的平均反应速率v(N2)= ;t1℃时该反应的平衡常数K= .
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是 .
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积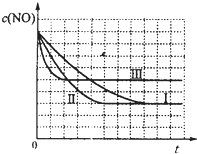
(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据表2设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
则曲线Ⅰ、Ⅱ、Ⅲ对应的实验编号依次为 .
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1
则处理汽车尾气反应中的a= .
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H4.向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,
有关数据如表3.
平衡后升高温度,再次达到平衡测得容器中NO、N2、CO2的浓度之比为5:3:3,则△H4 O(填“>”、“=”或“<”).
查看习题详情和答案>>
2NO(g)+2CO(g)
| 催化剂 |
为了测定在某种催化剂作用下该反应的反应速率,t1℃下,在一等容的密闭容器中,某科研机构用气体传感器测得了不同时间的NO和CO的浓度如表1(CO2和N2的起始浓度为0).
表1
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol?L-1 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/×10-3mol?L-1 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
(1)在上述条件下该反应能自发进行,则正反应必然是
(2)前3s内的平均反应速率v(N2)=
(3)假设在密闭容器中发生上述反应,达到平衡时改变下列条件,能提高NO转化率的是
A.选用更有效的催化剂 B.升高反应体系的温度
C.降低反应体系的温度 D.缩小容器的体积

(4)研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.根据表2设计的实验测得混合气体中NO的浓度随时间t变化的趋势如图1所示:
| 实验编号 | T/℃ | NO初始浓度/mol?L-1 | CO初始浓度/mol?L-1 | 催化剂的比表面积/m2?g-1 |
| ① | 350 | 1.20×10-2 | 5.80×10-2 | 124 |
| ② | 280 | 1.20×10-2 | 5.80×10-2 | 124 |
| ③ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
(5)已知:N2(g)+O2(g)=2NO(g)△H1=+180.5kJ?mol-1
2C(s)+O2(g)=2CO(g)△H2=-221.0kJ?mol-1
C(s)+O2(g)=CO2(g)△H3=-393.5kJ?mol-1
则处理汽车尾气反应中的a=
(6)用活性炭还原法也可以处理氮氧化物,有关反应为:C(s)+2NO(g)?N2(g)+CO2(g)△H4.向某密闭容器加入一定量的活性炭和NO,在t2℃下反应,
有关数据如表3.
| NO | N2 | CO | |
| 起始浓度mol.L-1 | 0.10 | 0 | 0 |
| 平衡浓度/mol.L-1 | 0.04 | 0.03 | 0.03 |
一定温度下,测得某纯水的pH为6.5.试计算:
(1)此时水的离子积常数Kw=
(2)若在此纯水中加一定量Ba(OH)2固体,配制成5.0×10-5 mol?L-1的Ba(OH)2溶液,保持原温度,其溶液的pH=
(3)取上述Ba(OH)2溶液200mL,加入等体积的一定物质的量浓度的Na2SO4溶液,则产生沉淀所需Na2SO4溶液的最小浓度要
(4)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请估算该反应的平衡常数?(列式计算)
查看习题详情和答案>>
(1)此时水的离子积常数Kw=
10-13
10-13
.(2)若在此纯水中加一定量Ba(OH)2固体,配制成5.0×10-5 mol?L-1的Ba(OH)2溶液,保持原温度,其溶液的pH=
9
9
.(3)取上述Ba(OH)2溶液200mL,加入等体积的一定物质的量浓度的Na2SO4溶液,则产生沉淀所需Na2SO4溶液的最小浓度要
8.0×10-6
8.0×10-6
mol.L-1[Ksp(BaSO4)=1.0×10-10].(4)氯气在295K、100Kpa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请估算该反应的平衡常数?(列式计算)
Cl2(aq)+H2O(l)=H+(aq)+Cl-(aq)+HClO(aq)
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
=
=4.5×10-4 ,
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
Cl2(aq)+H2O(l)=H+(aq)+Cl-(aq)+HClO(aq)
起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
=
=4.5×10-4 ,
.起始:0.0900 0
转化:0.030.030.030.03
平衡:0.060.030.030.03
平衡常数K=
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
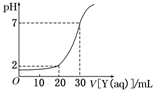 如图为对15mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,根据图象推出X(mol/L)和Y(mol/L)的物质的量浓度是下表内各组中的( ) 如图为对15mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图象,根据图象推出X(mol/L)和Y(mol/L)的物质的量浓度是下表内各组中的( )
|
查看习题详情和答案>>