摘要:31. 右图所示的装置在实验室中用途比较广泛: (1)排空气法收集气体.若收集CO2气体.进气口为 . (2)若瓶中装满水.可用于收集下列气体中的 . ①NO ②NO2 ③NH3 ④HCl 此时进气口为 . (3)若瓶中所盛气体为CO.如要产生平稳的CO气流. 则可将 接在自来水龙头上.然后缓缓打开龙 头.即可排出实验中所需要的CO. (4)如果广口瓶中盛放浓硫酸.可用作气体干燥装置.则该装置不可以干燥的气体有 . ①HCl ②NH3 ③H2 ④CO (5)此装置还可用于除去气体中的杂质气体.若要用此装置除去CO2中混有的少量SO2气体.则装置中应盛放的液体可能是 . ①NaOH溶液 ②酸性KMnO4溶液 ③NaHCO3溶液 ④浓H2SO4
网址:http://m.1010jiajiao.com/timu3_id_40495[举报]
 “酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.
“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
(2)饱和碳酸钠溶液的主要作用是
中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味
中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味
、溶解挥发出来的乙醇,降低乙酸
溶解挥发出来的乙醇,降低乙酸
、乙酯在水中的溶解度,便于分层得到酯
乙酯在水中的溶解度,便于分层得到酯
.(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是
防倒吸
防倒吸
.(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
.(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
防止大试管中液体暴沸而冲出导管
防止大试管中液体暴沸而冲出导管
. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取用CH3COOH与C2H518OH发生反应制取乙酸乙酯的化学反应方程式
CH3COOH+H18OCH2CH3 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O
 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2OCH3COOH+H18OCH2CH3 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O
 CH3CO18OCH2CH3+H2O
CH3CO18OCH2CH3+H2O(2)浓硫酸的作用是:①
催化作用
催化作用
;②吸水作用
吸水作用
.(3)实验中饱和Na2CO3溶液的作用是(填字母序号)
BC
BC
.A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的小,有利于分层析出
D、加速酯的生成,提高其产率
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,为了防止
倒吸
倒吸
.(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
.(6)在该实验中,若用1mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?为什么?
不能;该反应是可逆反应,反应不能进行到底;
不能;该反应是可逆反应,反应不能进行到底;
(7)下列描述能说明酯化反应已达到化学平衡状态的有(填序号)
②④⑤
②④⑤
.①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
 红酒密封储存时间越长,质量越好,其原因之一是储存过程中生成了具有香味的酯.在实验室可以用右图所示的装置制取乙酸乙酯.请回答:
红酒密封储存时间越长,质量越好,其原因之一是储存过程中生成了具有香味的酯.在实验室可以用右图所示的装置制取乙酸乙酯.请回答:(1)写出该反应的化学方程式
(2)下列试剂中,可用于鉴别乙醇和乙酸的是
①水 ②紫色石蕊试液 ③碳酸钙
(3)实验前a试管中盛放的是
1,2,3,4-四氢化萘的结构简式如 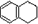 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉.
②慢慢滴入液溴,不断搅拌,直到反应完全.
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失.过滤,将滤液倒入分液漏斗,静置.
④分液,得到的“水层”即氢溴酸溶液.回答下列问题:
(1)如右图所示的装置,适合步骤①和②的操作的是
(2)步骤③中补充少量四氢化萘的目的是
(3)步骤③中过滤后得到的固体物质是
(4)在④获得的浓溶液中加入乙醇并加热,可获得一种不溶于水的有机物,写出该反应的方程式
(5)乙炔能被酸性高锰酸钾溶液氧化,请配平其相应的方程式:
查看习题详情和答案>>
 ,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
,分子式是C10H12.常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2→C10H8Br4+4HBr.生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉.
②慢慢滴入液溴,不断搅拌,直到反应完全.
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失.过滤,将滤液倒入分液漏斗,静置.
④分液,得到的“水层”即氢溴酸溶液.回答下列问题:
(1)如右图所示的装置,适合步骤①和②的操作的是
D
D
;(2)步骤③中补充少量四氢化萘的目的是
反应掉多余的Br2
反应掉多余的Br2
;(3)步骤③中过滤后得到的固体物质是
四溴化萘和铁粉
四溴化萘和铁粉
.(4)在④获得的浓溶液中加入乙醇并加热,可获得一种不溶于水的有机物,写出该反应的方程式
CH3CH2OH+HBr
CH3CH2Br+H2O
| △ |
CH3CH2OH+HBr
CH3CH2Br+H2O
;实验室制取乙炔可用上图中的装置D,这时分液漏斗中的液体通常是| △ |
饱和食盐水
饱和食盐水
.(5)乙炔能被酸性高锰酸钾溶液氧化,请配平其相应的方程式:
1
1
C2H2+2
2
KMnO4+3
3
H2SO4=1
1
K2SO4+2
2
MnSO4+2
2
CO2+4
4
H2O. (2009?江苏)下列有关试验操作的叙述正确的是( )
(2009?江苏)下列有关试验操作的叙述正确的是( )