摘要:2.活性中心吸附论 合成氨中铁做催化剂时.铁在适当温度.例如500℃-550℃时做为活性中心.吸附氮分子.使氮分子的化学键变弱.进而使化学键破裂而离解为氮原子.气体氢分子与铁表面吸附的氮原子作用.逐步反应形成氨.可表示为: 上述反应过程需要的活化能降低了.使活化分子百分数增高.因而反应速率大大增加. 在有气体参加的反应中.使用催化剂.由于催化剂中心的吸附产生中间产物.并使反应物在活性中心周围的浓度增大.活化分子增多.有效碰撞机会增大.从而使反应速率增大.以上两个学说是与有效碰撞理论有关的.
网址:http://m.1010jiajiao.com/timu3_id_39359[举报]
 催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.请回答下列问题:
(1)C、N、O的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(2)写出基态Fe的核外电子排布式
ls22s22p63s23p63d64s2
ls22s22p63s23p63d64s2
.(3)配合物Cu(NH3)3(CO)Ac中含有的化学键是
BCDF
BCDF
.A.金属键 B.离子键 C.非极性键 D.配位键 E.氢键 F.极性键
(4)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团.写出与CO互为等电子体的离子
CN-
CN-
(任写一个).(5)在一定条件下NH3与CO能合成化肥尿素[CO(NH2)2],尿素中C原子轨道的杂化类型为
sp2
sp2
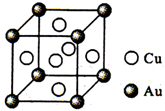
.(6)铜金合金形成的晶胞如图所示.其中Cu、Au原子个数比为
3:l
3:l
,预测其熔点比铜的低
低
(填“高”“相等”或“低”).
催化剂中毒是微量杂质和催化剂活性中心的某种化学成分作用,形成没有活性的物质.CO会使合成氨的催化剂(还原铁)中毒,CO易与Fe发生反应Fe+5CO═Fe(CO)5.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac.
请回答下列问题:
(1)C、N、O的第一电离能由小到大的顺序为______.
(2)写出基态Fe的核外电子排布式______.
(3)配合物Cu(NH3)3(CO)Ac中含有的化学键是______.
A.金属键 B.离子键 C.非极性键 D.配位键 E.氢键 F.极性键
(4)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团.写出与CO互为等电子体的离子______(任写一个).
(5)在一定条件下NH3与CO能合成化肥尿素[CO(NH2)2],尿素中C原子轨道的杂化类型为______.
(6)铜金合金形成的晶胞如图所示.其中Cu、Au原子个数比为______,预测其熔点比铜的______(填“高”“相等”或“低”).
 查看习题详情和答案>>
查看习题详情和答案>>
请回答下列问题:
(1)C、N、O的第一电离能由小到大的顺序为______.
(2)写出基态Fe的核外电子排布式______.
(3)配合物Cu(NH3)3(CO)Ac中含有的化学键是______.
A.金属键 B.离子键 C.非极性键 D.配位键 E.氢键 F.极性键
(4)等电子体指价电子数和原子数(氢等轻原子不计在内)相同的分子、离子或基团.写出与CO互为等电子体的离子______(任写一个).
(5)在一定条件下NH3与CO能合成化肥尿素[CO(NH2)2],尿素中C原子轨道的杂化类型为______.
(6)铜金合金形成的晶胞如图所示.其中Cu、Au原子个数比为______,预测其熔点比铜的______(填“高”“相等”或“低”).
 查看习题详情和答案>>
查看习题详情和答案>>
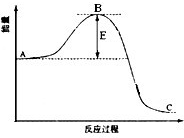 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题:(1)该反应通常用活性铁作催化剂,加活性铁会使图中B点
降低
降低
(填升高、降低或不变),理由是因为催化剂改变了反应的历程使活化能E降低
因为催化剂改变了反应的历程使活化能E降低
;(2)该反应平衡常数表达式为:K=
| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
<
<
K(填“<”、“>”或“=”)时,反应向右进行.(3)450℃时该反应的平衡常数
>
>
500℃时的平衡常数(填“<”、“>”或“=”).(4)一定条件下的密闭容器中,该反应达到平衡,要提高H2的转化率,可以采取的措施是
ce
ce
(填字母代号).a.高温高压 b.加入催化剂 c.增加N2的浓度
d.增加H2的浓度 e.分离出NH3
(5)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
BC
BC
.A.c1<c2 B.2c1<c3 C.a1+a2=1 D. a2<a3.
(2011?怀化一模)化学一化学与技术
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
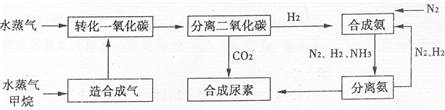
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
②
(2)依据流程圈,判断下列说法正确的是
A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
.降低温度K减小,则正反应是一个
查看习题详情和答案>>
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)

请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
2NH3+CO2
NH2COONH4
| ||
2NH3+CO2
NH2COONH4
;
| ||
②
NH2COONH4
CO(NH2)2+H2O
| ||
NH2COONH4
CO(NH2)2+H2O
.
| ||
(2)依据流程圈,判断下列说法正确的是
C
C
.A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
500℃的温度反应速率较快,催化剂活性最高
500℃的温度反应速率较快,催化剂活性最高
.(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
吸
吸
热反应.当造合成气的反应中甲烷的转化率为75%.合成氨中氢气的转化率为40%(其他过程的损失不计)以5.60xlO7L甲烷为原料能够合成4.48xlO7L
4.48xlO7L
L氨气.(假设体积均在标准状况下测定)