摘要:26.(1)加少量KClO3.插上Mg条并将其点燃 Fe (2)Fe2O3+6HCl=2FeCl3+3H2O MgO+2HCl=MgCl2+H2O (3)Fe+2H+=Fe2++H2↑ Fe+2Fe3+=3Fe2+ (4)c(Mg2+) 0.67mol·. c(Fe2+) 2.3mol·.
网址:http://m.1010jiajiao.com/timu3_id_35989[举报]
如图表示各物质之间的转化关系.已知A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液.

请按要求填空:
(1)写出B的电子式:
(2)反应⑤的现象是
(3)反应①的化学反应方程式是
(4)反应⑥的离子方程式是
查看习题详情和答案>>

请按要求填空:
(1)写出B的电子式:
Na+[ ]2-Na+
]2-Na+
 ]2-Na+
]2-Na+Na+[ ]2-Na+
]2-Na+
. ]2-Na+
]2-Na+(2)反应⑤的现象是
迅速由白色变成灰绿色最终变为红褐色
迅速由白色变成灰绿色最终变为红褐色
.(3)反应①的化学反应方程式是
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
,在实验室引发反应④的操作是
| ||
在铝热剂上加少量KClO3,插上镁条并将其点燃
在铝热剂上加少量KClO3,插上镁条并将其点燃
.(4)反应⑥的离子方程式是
2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑
.合理、高效利用金属矿物,将其中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼.
(1)以HgO为原料冶炼Hg,冶炼方法是
(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:
(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应.下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:

查看习题详情和答案>>
(1)以HgO为原料冶炼Hg,冶炼方法是
加热分解法
加热分解法
.(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:
2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
 Al2O3+2Fe
Al2O3+2Fe2Al+Fe2O3 Al2O3+2Fe
Al2O3+2Fe
.引发铝热反应的实验操作是: Al2O3+2Fe
Al2O3+2Fe加少量KClO3,插上Mg条并将其点燃
加少量KClO3,插上Mg条并将其点燃
.(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应.下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:
b
b
(填字母).
物质之间的转化关系如下图,其中A、D、E、F、H为常见单质,其余为化合物,且单质E和单质F在点燃或加热的条件下生成淡黄色的固体,B常温下为液态化合物.
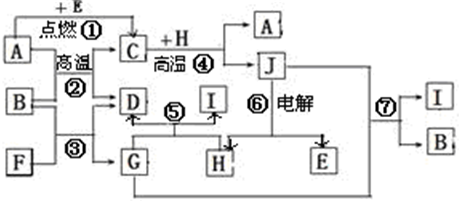
试回答下列有关问题:
(1)A在元素周期表的位置
(2)分别写出反应②⑦的化学方程式
(3)写出引发反应④的实验操作
(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:
查看习题详情和答案>>

试回答下列有关问题:
(1)A在元素周期表的位置
4
4
周期Ⅷ
Ⅷ
族.(2)分别写出反应②⑦的化学方程式
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
;
| ||
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
.(3)写出引发反应④的实验操作
加少量KClO3,插上镁条并将其点燃
加少量KClO3,插上镁条并将其点燃
;(4)写出用A与H作电极材料插入G溶液形成闭合电路后的负极反应式是:
Al-3e-+4OH-═AlO2-+2H2O
Al-3e-+4OH-═AlO2-+2H2O
.(5)写出上图中物质C与稀HNO3溶液反应的离子方程式:
3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O
3Fe3O4+NO3-+28H+═9Fe3++NO↑+14H2O
.A、B、C、D、E是中学化学常见单质,构成它们的元素的原子序数分别为a、b、c、d、е;且3(a+b)=2(a+c)=3(d-a);X、Y、Z、M、N、W、H、K是常见化合物,X是B和C的化合产物,它们之间有如下转化关系(图中反应物和产物中的H2O已略去):
(1)Y的电子式为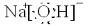
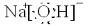 ,构成E单质的元素的原子结构示意图为:
,构成E单质的元素的原子结构示意图为: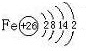
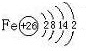 .
.
(2)反应③的离子方程式为
(3)E的氧化物与D在一定条件下反应的化学方程式为:
(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
(5)用离子方程式表示Z溶液显碱性的原因:
(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
查看习题详情和答案>>

(1)Y的电子式为
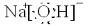
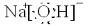
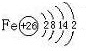
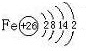
(2)反应③的离子方程式为
Al3++3AlO2-+6H2O=4Al(OH)3↓
Al3++3AlO2-+6H2O=4Al(OH)3↓
.(3)E的氧化物与D在一定条件下反应的化学方程式为:
Fe2O3+2Al
2Fe+Al2O3
| ||
Fe2O3+2Al
2Fe+Al2O3
,在实验室中,引发该反应的实验操作为
| ||
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
将铝粉与氧化铁粉末混合均匀,在混合物上方撒少量氯酸钾,插上一根镁条,并点燃镁条
.(4)已知常温下,1gA的单质与C的单质在点燃条件下完全反应,放出的热量为92.3kJ,写出W分解生成A和C的热化学方程式
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
2HCl(g)═H2(g)+Cl2(g)△H=+184.6kJ/mol
.(5)用离子方程式表示Z溶液显碱性的原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(6)固体N常温下即挥发,183℃升华,几乎溶于所有的有机溶剂和H2O中,据此判断N为
分子
分子
晶体.(7)25℃时,PH=5的W和N的水溶液中由H2O电离出来的H+离子浓度之比为
1:104
1:104
. 实验室制取氯气方法很多,通常有如下三种:
实验室制取氯气方法很多,通常有如下三种:(1)用二氧化锰与浓盐酸共热制取氯气.如果将过量二氧化锰与20mL 12mol/L的浓盐酸混合加热,充分反应后生成的氯气明显少于0.06mol.产生该结果的主要原因是:①
(2)高锰酸钾与浓盐酸反应可制取氯气,其反应的化学方程式为:
若消耗0.1mol氧化剂,则被氧化的还原剂的物质的量为
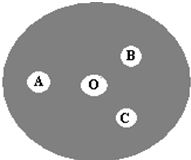
(3)现按如下操作进行有关氯气的制备及性质实验:在一片下衬白纸的圆形玻璃片上(如图),A点滴一滴0.1mol/LKI溶液(含淀粉溶液),B点滴一滴FeSO4(含KSCN)
溶液,C点滴一滴NaOH(含酚酞)溶液,O点放少量KClO3晶体.向KClO3晶体滴加一滴浓盐酸,立即用表面
皿盖好.试回答下列问题:
①A点反应的离子方程式为
②B点的现象为
③C点的溶液由红色变为无色,是因为中和褪色还是漂白而褪色,请你设计实验证明之.