网址:http://m.1010jiajiao.com/timu3_id_35896[举报]
(08长沙雅礼中学二模)(14分)I、新能源的开发利用是当今全球的一个重大研究课题,发展氢能源有着广阔的前景,有研究人员提出了“利用太阳能,以水为原料,大量生产氢气,并用作各种机械的动力燃料”这一设想。试回答下列问题:
(1)你认为这一设想能否实现?___________。(填“能”、“不能”)
(2)氢气作为燃料与现在广泛使用的化石燃料相比有什么优点?(要求答出两点)
①__________ _;②__________ 。
(3)燃料电池是一种新型的无污染、无噪音、高效率的发电设备,也是一种很有发展潜力的新能源。在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
①燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:正极____________________________.
②氢氧燃料电池可作为载人航天器的首选电池,除它有作为燃料电池的优点外,还有一个重要原因是__。
II、环境保护是当今世界关注的热点问题。
(1)为了降低汽车尾气对空气的污染,可用纳米级的某种氧化物作催化剂,使尾气中的CO与氮氧化物(NO)反应,转化为空气中含有的两种气体(其中一种为单质),该反应的化学方程式为__________ 。
(2)超临界CO2流体是一种与水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。它作为“绿色环保溶剂”的原因之一是:能代替许多有害、有毒、易燃的有机溶剂;之二是_______。
查看习题详情和答案>>
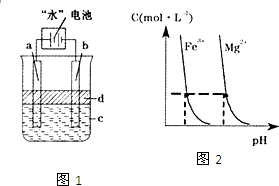 “水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有
“水”电池是利用淡水与海水之间含盐量的差别进行发电的一种新型电池.(1)研究表明,电池用二氧化锰纳米棒为正极材料可提高发电效率,这是利用纳米材料具有(3)利用电解实验可以制得纯净的Fe(OH)2白色沉淀,如图1,已知两电极的材料分别为石墨和铁.
①若图中的电池为“水”电池,则其与a极相连的电极是由下列物质中的
A.MnO2 B.Ag C.NaCl D.Na2Mn5O10 E.AgCl
②a极的电极反应式为
③电解液c可以是
A.纯水 B.NaCl溶液 C.H2SO4溶液 D.CuCl2溶液
④当生成1mol Fe(OH)2白色沉淀时将消耗MnO2
(4)某温度下,Fe(OH)3(s)、Mg(OH)2(s)分别在溶液中达到沉淀溶解平衡后,溶液中金属阳离子的浓度与溶液pH的关系如图2.请据图2分析:①该温度下,溶度积常数的关系为:KSP[Fe(OH)3]
KSP[Mg(OH)2](填“>”、“=”或“<”);
②如果在新生成的Mg(OH)2浊液中滴入足量的Fe3+,振荡后,白色沉淀会全部转化为红褐色沉淀,原因是
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.I.氢氧燃料电池能量转化率高,具有广阔的发展前景.现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是
A.a电极是负极,OH-移向负极
B.b电极的电极反应为:O2+2H2O+4e-=4OH-
C.电池总反应式为:2H2+O2
| ||
D.电解质溶液的pH保持不变
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol?L-1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=
II氢气是合成氨的重要原料.工业上合成氨的反应是:N2(g)+3H2(g)?2NH3(g)△H=-92.20kJ?mol-1.
(1)下列事实中,不能说明上述可逆反应已达到平衡的是
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N-H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1:3:2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
①反应进行到2小时时放出的热量为
②此条件下该反应的化学平衡常数K=
| 4 |
| 27 |
| 4 |
| 27 |
③反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向
燃料电池是一种新型的无污染、无噪音、高效率的发电设备,是一种很有发展潜力的新能源,它主要由燃料、氧化剂、电极和电解质组成,燃料电池的结构和传统电池一样具有正负电极,正负电极被电解质分隔,它以还原剂(用氢作燃料)为负极反应物,以氧化剂(如空气中的氧气等)为正极交换物,在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
(1)燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:负极______________;正极______________.
(2)氢氧燃料电池可作为载人航天器的首选电池,一个重要原因是它在产生持续电流的过程中生成的产物是水,这正好解决航天员的饮水问题,航天员饮用这些合成水通过消化系统,大部分在被___________吸收.
燃料电池是一种新型的无污染、无噪音、高效率的发电设备,是一种很有发展潜力的新能源,它主要由燃料、氧化剂、电极和电解质组成,燃料电池的结构和传统电池一样具有正负电极,正负电极被电解质分隔,它以还原剂(用氢作燃料)为负极反应物,以氧化剂(如空气中的氧气等)为正极交换物,在燃料电池中,氢气等燃料在通常条件下就能在电极上进行电极反应(一般用多孔镍、铂等作电极材料).电池中的电解质为有机高分子高聚物,它可以交换质子.
(1)燃料电池的电极在常温条件下就能持续发生电极反应,写出氢氧燃料电池中的电极反应式:负极______________;正极______________.
(2)氢氧燃料电池可作为载人航天器的首选电池,一个重要原因是它在产生持续电流的过程中生成的产物是水,这正好解决航天员的饮水问题,航天员饮用这些合成水通过消化系统,大部分在被___________吸收.
查看习题详情和答案>>