摘要:影响工业区位的因素很多.不同工业部门具有不同的区位指向.回答1-2题. 1.区位宜接近原料产地的是 A 葡萄酒厂.羊毛加工厂.水果罐头厂 B 服装加工厂.羊毛加工厂.水果罐头厂 C 造船厂.飞机制造厂.电子装配厂 D 钢铁厂.时装加工厂.家具厂 2.啤酒厂.家具厂.面包加工厂的区位属于 A 原材料指向型 B 技术指向型 C 劳动力指向型 D 市场指向型
网址:http://m.1010jiajiao.com/timu3_id_35223[举报]
影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象 ;
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 ;
(3)工业上常将固体燃料粉碎,以提高燃烧效率 ;
(4)硫在氧气中比在空气中燃烧更快 ;
(5)工业合成氨通常要在高压下进行 。
查看习题详情和答案>>
影响化学反应速率的因素很多。在下列事实中,影响反应速率的外界条件分别为:
(1)夏天的食品易霉变,冬天不易发生该现象 ;
(2)在5﹪的H2O2溶液中加入1滴~2滴1mol∕LFeCl3溶液,很快产生气体 ;
(3)工业上常将固体燃料粉碎,以提高燃烧效率 ;
(4)硫在氧气中比在空气中燃烧更快 ;
(5)工业合成氨通常要在高压下进行 。
(2010?和平区一模)(Ⅰ)食品安全关系国计民生,影响食品安全的因素很多.
(1)聚偏二氯乙烯( )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7C00H]含量很低.下列关于亚油酸的说法中,正确的是
A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.不能使酸性KMnO4溶液褪色
(Ⅱ)香精( )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
已知:A具有两种一氯代物B和C

回答下列问题:
(1)和 互为同分异构体的是
互为同分异构体的是

(2)D物质的名称为
(3)高分子F的结构简式为
 ;
;
(4)写出H和I反应生成三酯的化学方程式:
 .
.
查看习题详情和答案>>
(1)聚偏二氯乙烯(
 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2
CCl2=CH2
(写结构简式)发生加聚反应生成的.(2)劣质植物油中的亚油酸[CH3(CH2)4CH=CHCH2CH=CH(CH2)7C00H]含量很低.下列关于亚油酸的说法中,正确的是
BC
BC
(填序号).A.分子式为C18H34O2 B.一定条件下能与甘油(丙三醇)发生酯化反应
C.能和NaOH溶液反应 D.不能使酸性KMnO4溶液褪色
(Ⅱ)香精(
 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其它两种有机物的路线如下.已知:A具有两种一氯代物B和C

回答下列问题:
(1)和
 互为同分异构体的是
互为同分异构体的是①②④
①②④
(填序号).
(2)D物质的名称为
1,2-二溴丙烷
1,2-二溴丙烷
.(3)高分子F的结构简式为


(4)写出H和I反应生成三酯的化学方程式:


影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题.
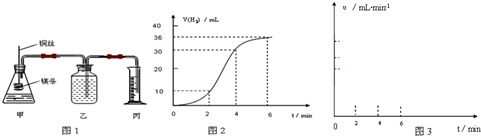
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
查看习题详情和答案>>

(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中.足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示.
①请在图3 的方框中画出上述反应的速率与时间的关系曲线.并标出纵坐标的刻度值
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因:
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+浓度降低,所以导致反应速率减小
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快.他决定对其原因进行探究.填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO42-对反应没有影响;
原因Ⅱ:
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
Cl-对反应没有影响,而SO42-对反应具有阻碍作用
;原因Ⅲ:Cl-对反应具有促进作用,而SO42-对反应具有阻碍作用;
原因Ⅳ:Cl-、SO42-均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ:
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大)
.②该同学设计并进行了两组实验,即得出了正确结论.他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量NaCl或KCl固体,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量Na2SO4或K2SO4固体,观察反应速率是否变化.若观察到实验a中
反应速率加快
反应速率加快
,实验b中反应速率减慢
反应速率减慢
,则说明原因Ⅲ是正确的.依此类推.该同学通过分析实验现象,得出了结论:Cl-对反应具有加速作用.