摘要: 如图所示.在250毫升的锥形瓶中.充满某种无色.有刺激性气味的气体.分液漏斗中装有NaOH溶液并滴加了酚酞指示剂.导管的A端通大气.B端捆有一小气囊.在标准状况下进行如下实验:开启分液漏斗活塞.滴加10毫升溶液时只见气球迅速胀大.溶液也恰好由红色变为无色. 则原来在锥形瓶中装有的气体是 . 发生上述现象的原因是: . 分液漏斗中的NaOH溶液摩尔浓度不超过 . [解答]: 2. 某同学在实验室里.制备乙烯气体.进行了如下的实验操作: ①.检查了制备装置的气密性. ②.在烧瓶中加入10毫升浓硫酸.再加入无水酒精10毫升后把整个装置固定好. ③.加热至沸腾后.用向上排气法收集乙烯气体. 根据该同学的实验操作和发生的有关现象.填写下列空白: (1). 该同学在上述①--③的操作中的错误是: a. , b. , c. . (2). 在加热的烧瓶中.常放入一些碎玻璃片.它的作用是 . (3). 实验中.所用温度计应放的位置是 . (4). 实验中.烧瓶内的液体常变成棕黑色.再加强热并会有刺激性的气体产生. 写出发生此变化的化学反应方程式 .
网址:http://m.1010jiajiao.com/timu3_id_34531[举报]
(2013?重庆二模)如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出.
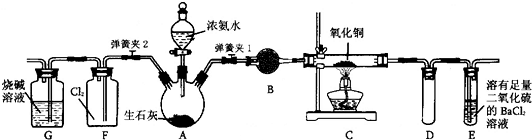
(1)在组装好装置后,若要检验A-E装置的气密性,其操作是:首先
(2)装置B中盛放试剂是
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量.若反应前固体质量为16g,反应后称重固体质量减少2.4g.通过计算确定该固体产物的成分是
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中.写出产生白烟的化学方程式
查看习题详情和答案>>

(1)在组装好装置后,若要检验A-E装置的气密性,其操作是:首先
首先关闭弹簧夹2和分液漏斗活塞
首先关闭弹簧夹2和分液漏斗活塞
,打开弹簧夹1,在E中装入水后
打开弹簧夹1,在E中装入水后
然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成说明装置气密性良好.(2)装置B中盛放试剂是
碱石灰
碱石灰
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生
白色沉淀
白色沉淀
(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式NH3+Cu
Cu+N2↑+H2O
| ||
NH3+Cu
Cu+N2↑+H2O
| ||
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量.若反应前固体质量为16g,反应后称重固体质量减少2.4g.通过计算确定该固体产物的成分是
Cu2O、Cu
Cu2O、Cu
(用化学式表示)(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中.写出产生白烟的化学方程式
3Cl2+8NH3=N2+6NH4Cl
3Cl2+8NH3=N2+6NH4Cl
,迅速产生倒吸的原因是盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸
盛满氯气的集气瓶中因氨气消耗氯气生成部分固体,导致内压减小,引起溶液倒吸
. 如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清.请回答:
如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种.某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清.请回答:(1)四座工厂排出的废水里含有的污染物分别为:
甲
Ca(OH)2
Ca(OH)2
;乙FeCl3
FeCl3
;丙HCl
HCl
;丁Na2CO3
Na2CO3
.(填化学式)(2)在丁的下游M处取出的河水中,肯定含有的离子是
Na+、Ca2+、Fe3+、H+、Cl-
Na+、Ca2+、Fe3+、H+、Cl-
.(3)写出有关反应的离子方程式:
Fe3++3 OH-=Fe(OH)3↓;Fe(OH)3+3H+=Fe3++3H2O;CO32-+2H+=H2O+CO2↑
Fe3++3 OH-=Fe(OH)3↓;Fe(OH)3+3H+=Fe3++3H2O;CO32-+2H+=H2O+CO2↑
.(4)小河中鱼、虾几乎绝迹的原因是
河水中的酸碱性及有害物质的富集,直接危害鱼、虾等生物的生长
河水中的酸碱性及有害物质的富集,直接危害鱼、虾等生物的生长
. 由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.
由黄铜矿(主要成分是CuFeS2)可以冶炼得到粗铜,再经过电解精炼得到纯铜.(1)黄铜矿冶炼得到粗铜的一步反应为:8CuFeS2+21O2
| ||
Cu、O
Cu、O
(填元素符号).根据原电池原理,稀硫酸做电解质溶液,使用惰性电极,一极通入SO2,另一极通入O2,治理SO2污染,负极反应的离子方程式为
SO2-2e-+2H2O=SO42++4H+
SO2-2e-+2H2O=SO42++4H+
(2)粗铜的电解精炼如图所示.在粗铜的电解过程中,纯铜板应是图中电极
d
d
(填图中的字母);在电极d上发生的电极反应式为Cu2++2e-=Cu
Cu2++2e-=Cu
;若粗铜中还含有金、银、铁,它们在电解槽中的存在形式位置为Au、Ag以单质的形成沉积在c(阳极)下方,Fe以Fe2+的形式进入溶液中
Au、Ag以单质的形成沉积在c(阳极)下方,Fe以Fe2+的形式进入溶液中
.(3)生物炼铜近几年来逐渐被重视,其原理是:在细菌的帮助下,氧气氧化硫化铜矿石为可溶解性硫酸铜,再进行简单的后续生产.生物炼铜与高温火炼铜相比,优点有
污染小、能量消耗少、反应条件简单等
污染小、能量消耗少、反应条件简单等
(回答两点)硫酸铜可以配制波尔多液,杀灭果树上的某些细菌,其杀菌原理是Cu2+可以使蛋白质变性
Cu2+可以使蛋白质变性
. 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.(1)已知:N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ?mol-1
2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ?mol-1
①N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=
-622.2
-622.2
kJ?mol-1.②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是
△H>0,△S<0
△H>0,△S<0
.③用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是
NaClO+2NH3═N2H4+NaCl+H2O
NaClO+2NH3═N2H4+NaCl+H2O
.(2)采矿废液中的CN-可用H2O2处理.已知:H2SO4═H++HSO
- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
2HSO4--2e-═S2O82-+2H+
2HSO4--2e-═S2O82-+2H+
.(3)氧化镁处理含NH
+ 4 |
MgO+H2O?Mg(OH)2;
Mg(OH)2+2NH
+ 4 |
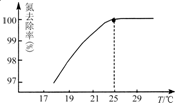
①温度对氮处理率的影响如图所示.在25℃前,升高温度氮去除率增大的原因是
升高温度NH3的溶解度降低,有利于NH3的逸出
升高温度NH3的溶解度降低,有利于NH3的逸出
.②剩余的氧化镁,不会对废水形成二次污染,理由是
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染
.(4)滴定法测废水中的氨氮含量(氨氮以游离氨或铵盐形式存在于水中)步骤如下:①取10mL废水水样于蒸馏烧瓶中,再加蒸馏水至总体积为175mL;②先将水样调至中性,再加入氧化镁使水样呈微碱性,加热;③用25mL硼酸吸收蒸馏出的氨[2NH3+4H3BO3═(NH4)2B4O7+5H2O];④将吸收液移至锥形瓶中,加入2滴指示剂,用c mol?L-1的硫酸滴定至终点[(NH4)2B4O7+H2SO4+5H2O═(NH4)2SO4+4H3BO3],记录消耗的体积V mL.则水样中氮的含量是
2 800cV
2 800cV
mg?L-1(用含c、V的表达式表示). 如图所示,在一熟苹果切片上分别滴上1滴碘水和1滴银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断中正确的是( )
如图所示,在一熟苹果切片上分别滴上1滴碘水和1滴银氨溶液,颜色变化如图所示,根据这些实验现象的下列推断中正确的是( )