摘要:23.图9-10是某同学配制一定质量的0.9%生理盐水的全过程: (1)找出上图中的错误:① ,② ,③ . (2)如果配制的生理盐水中NaCl的质量分数小于0.9%.则可能造成误差的原因有:① ,② ,③ . (3)所用的玻璃仪器有 . 图9-10 答案:(1)①瓶塞放反了 ②砝码和药品放反了 ③用温度计搅拌 (2)计算错误:水算多了.氯化钠算少了 称量氯化钠时操作错误:天平读数有误.氯化钠和砝码放反了.左盘放了纸而右盘没有放.天平未调零等 用量筒量水时错误:读数时仰视 其他:氯化钠中混有杂质.烧杯中有水等 知识积累
网址:http://m.1010jiajiao.com/timu3_id_26530[举报]
某化学兴趣小组的同学想要绘制硝酸钾、食盐、氢氧化钙的溶解度曲线。用实验方法测定得到这三种物质在不同温度下在水中的溶解度数值,并记录如下:(图:硝酸钾、氯化钠、氢氧化钙在不同温度时的溶解度)
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 50 |
| 硝酸钾(克) | 13.3 | 31.6 | 37.7 | 48.8 | 63.9 | 92.5 |
| 氯化钠(克) | 35.7 | 35.8 | 36.0 | 36.3 | 36.5 | 36.8 |
| 氢氧化钙(克) | 0.19 | 0.18 | 0.17 | 0.16 | 0.14 | 0.12 |
(1)从表格或图像上分析:分离氯化钠和硝酸钾应采用的方法是 ;用此方法时,配制氯化钠和硝酸钾混合溶液的最佳温度为 ;分离时的最佳温度为 (从表格中选择数据填写)。在降温过程中,大量析出的物质是 ,为了提高晶体的纯度,应将过滤出的晶体用 (选填“热”或“冷”)水进一步洗涤干净。
(2)要把氢氧化钙的不饱和溶液转变成饱和溶液,可采取的方法有 、 和 。
查看习题详情和答案>> (2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
(2005?海门市)某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升?
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如下:
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数 .
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升 mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.
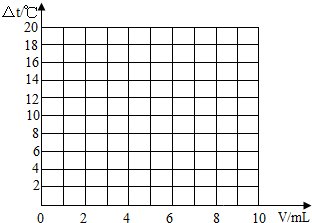
(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识. .
查看习题详情和答案>>
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.
某学校课外活动小组,对本地化工厂排放废水中的盐酸含量进行了测定.取废水50g,用2%的氢氧化钠溶液进行中和,当溶液pH=7时,用去氢氧化钠溶液20g.计算废水中盐酸的溶质质量分数.
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数______.
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升______mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
试在坐标系中绘出溶液温度变化与加入盐酸体积之间的变化关系图.

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.______.
查看习题详情和答案>>
在测定时,有同学发现在反应过程中,溶液有温度的变化,于是他们进一步进行了探究.
(1)①计算废水中盐酸的溶质质量分数______.
②配制100mL10%的盐酸(密度为1.05g/cm3).他们应量取38%的盐酸(密度为1.19g/cm3)多少毫升______mL.
(2)在一定体积的10%的氢氧化钠溶液中,慢慢滴入上述配制的10%的盐酸.有关实验中的数据记录如
| 加入盐酸的体积(V)/mL | 2 | 4 | 6 | 8 | 10 |
| 溶液温度变化(△t)/℃ | 5.2 | 9.6 | 13.0 | 16.0 | 18.2 |

(3)根据(2)中关系图,请你从能量变化的角度谈谈对中和反应的认识.______.
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.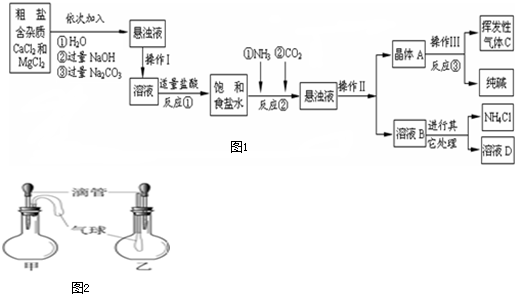
【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为: (1分);分离出NaHCO3,加热制得纯碱.
【生产流程】如图1
【相关资料】
(1)NH4Cl
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
【问题讨论】(1)操作Ⅰ、Ⅱ、Ⅲ中,相同操作的名称为 .
(2)反应①中发生了两个反应,写出这两个化学方程式:① ;② .
(3)反应③中得到纯碱的化学方程式为: .
(4)溶液B中的溶质有 (至少写出两种).
(5)上述生产流程中可循环使用的是 (填序号).
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法 .
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质 (写化学式).
【综合确定】
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO2 B.甲:水和NH4NO3;乙:双氧水和MnO2
C.甲:水和NH3;乙:硝酸银溶液和HCl D.甲:CaCO3固体和稀盐酸;乙:NaOH溶液和SO2
(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:①4NH3+5O2=4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O2和H2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中 ②将Fe、Cu分别加入到ZnSO4溶液中 ③将Zn分别加入到FeSO4、CuSO4溶液中 ④将Fe分别加入到ZnSO4、CuSO4溶液中.其中可行的是
A.①④B.①②C.②③D.③④
查看习题详情和答案>>

【产品与原理】该厂采用“侯氏制碱法”生产化工产品--纯碱(Na2CO3)和化肥NH4Cl.生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应的化学方程式为:
【生产流程】如图1
【相关资料】
(1)NH4Cl
| ||
(2)已知20℃时有关物质的溶解度如表(气体指1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
(2)反应①中发生了两个反应,写出这两个化学方程式:①
(3)反应③中得到纯碱的化学方程式为:
(4)溶液B中的溶质有
(5)上述生产流程中可循环使用的是
A.挥发性气体C B.溶液D C.氢氧化镁 D.化肥NH4Cl
(6)检验挥发性气体C的方法
【组成确定】
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀. 由上述实验可确定纯碱样品含有杂质
【综合确定】
(1)如图2所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都明显胀大.则滴管和烧瓶中所用试剂可能是:
A.甲:稀硫酸和铜片;乙:水和CO2 B.甲:水和NH4NO3;乙:双氧水和MnO2
C.甲:水和NH3;乙:硝酸银溶液和HCl D.甲:CaCO3固体和稀盐酸;乙:NaOH溶液和SO2
(2)小明同学把12gNaOH固体等分成A、B、C三份并采用不同方法保存.几天后,A未变质、B部分变质、C全部变质,他将三份固体分别配成溶液并滴入10%的稀硫酸直到正好反应.下列说法正确的是
A.几天后,三份固体的质量由小到大的顺序为:A<B<C
B.为控制正好反应,A可用酚酞试液指示,B、C可滴加稀硫酸直到正好不冒气泡
C.正好反应时,消耗稀硫酸的质量由大到小的顺序为:A>B>C
D.正好反应时,生成硫酸钠的质量都相等,均为7.1g
(3)工业上用氨气(NH3)制取硝酸(HNO3),工业流程为:①4NH3+5O2=4NO+6H2O ②2NO+O2=2NO2 ③3NO2+H2O=2HNO3+NO,下列判断不正确的是
A.①反应中使用的催化剂需要经常更换 B.在每一步反应中N元素的化合价都发生了改变
C.制取硝酸过程中产生的NO可循环使用
D.为实现原子利用率为100%,可在②③中控制NO、O2和H2O分子个数比为4:3:2
(4)某学生为了验证铁、锌、铜三种金属的活动性顺序.设计了四种方案:①将Zn、Cu分别加入到FeSO4溶液中 ②将Fe、Cu分别加入到ZnSO4溶液中 ③将Zn分别加入到FeSO4、CuSO4溶液中 ④将Fe分别加入到ZnSO4、CuSO4溶液中.其中可行的是
A.①④B.①②C.②③D.③④