网址:http://m.1010jiajiao.com/timu3_id_1577[举报]
[提出问题]如何才能将粗盐中难溶性杂质和可溶性杂质(氯化镁、氯化钙)除去,从而获得较纯的食盐晶体?
[资料准备]
| 20℃时,一些物质的溶解度 | ||
| OH- | CO32- | |
| Na+ | 溶 | 溶 |
| Ca2+ | 微 | 不 |
| Mg2+ | 不 | 微 |

[交流与表达]
(1)实验步骤①和②的目的是
(2)实验操作X的名称是
(3)实验步骤③的主要目的是
(4)实验步骤④中生成的沉淀D是
(5)实验步骤⑤用蒸发溶剂的方法而不用降低溶液温度的方法获取食盐晶体,原因是
[反思与评价]
(6)有同学认为只需要用氢氧化钠溶液和碳酸钠溶液中任意一种试剂就能将两种可溶性杂质出去,你认为这种方法
(7)有同学认为原实验方案不完善,做出这种评价的依据是
[实验方案设计]
(8)为了完善原实验方案,你设计的实验是
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为 。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O===NaN3+NaOH+X,实验室检验X 气体使用的试纸是湿润________。
【Na2CO3质量分数测定】工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体)。 (碱石灰是NaOH和CaO的混合物)

①精确称量样品,检查装置气密性;
②打开弹簧夹,鼓入空气,称量装置C;
③关闭弹簧夹,打开分液漏斗活塞;
④再打开弹簧夹, ;
⑤再次称量装置C。计算碳酸钠含量至少需要测定 (填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因 。
【NaN3纯度测定】精确称量0.140gNaN3样品,设计如图装置,测定其纯度。已知2NaN3
 3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。
3N2 (NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热。 
(5)使小试管中的NaN3样品与M溶液接触的操作是 。
(6)使用冷水冷凝的目的是 。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是 。
(7)常温下测得量气管读数为67.2 mL(N2的密度为 1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
【应用研究】
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为_______。
【制备研究】
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和
气体X,该反应的化学方程式为2NaNH3+N2O = NaN3+NaOH+X,实验室检验X
气体使用的试纸是湿润________。
【Na2CO3质量分数测定】
工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体)。
(3)装置A的作用是_____。设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,_______;⑤再次称量装置C。计算碳酸钠含量至少需要测定______(填数字)个数据。根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因_______。


(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差_____(填“变大”、“变小”或“不变”),说明气密性良好。

(5)使小试管中的NaN3样品与M溶液接触的操作是______。
(6)使用冷水冷凝的目的是______。反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是_______。
(7)常温下测得量气管读数为67.2 mL(N2的密度为1.25 g/L),则实验中选用的量气管规格合适的是_____(填字母序号)。
A. 100 mL B. 1 L C. 2 L
(8)计算NaN3样品的纯度(写出计算过程)。
查看习题详情和答案>>应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).
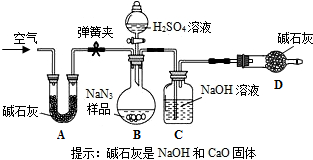
(3)装置A的作用是
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,
NaN3纯度测定:
精确称量0.140g NaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差
(5)使小试管中的NaN3样品与M溶液接触的操作是
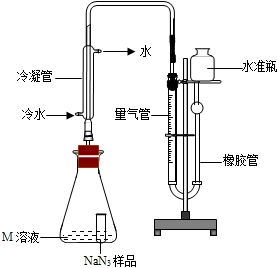
(6)使用冷水冷凝的目的是
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是
A.100mL B.1L C.2L
(8)计算NaN3样品的纯度(写出计算过程). 查看习题详情和答案>>
应用研究:
(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为______.
制备研究:
(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O=NaN3+NaOH+X,实验室检验X气体使用的试纸是湿润的______.
Na2CO3质量分数测定:工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图
装置(已知H2SO4溶液与NaN3,反应不生成气体).

(3)装置A的作用是______.设计的实验步
骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,______;⑤再次称量装置C.计算碳酸钠含量至少需要测定______(填数字)个数据.根据制备反应,分析工业级NaN3中含有Na2CO3的可能原因______.
NaN3纯度测定:
精确称量0.140gNaN3样品,设计如图装置,测定其纯度.已知2NaN3→3N2
(NaN3中的N全部转化为N2,其他产物略),反应中放出大量的热.
(4)检查该装置气密性的方法是连接好装置,从水准瓶注水,量气管中液面与右边液面形成高度差,做好标记,一段时间后,两边高度差______(填“变大”、“变小”或“不变”),说明气密性良好.
(5)使小试管中的NaN3样品与M溶液接触的操作是______.

(6)使用冷水冷凝的目的是______.反应前应将液面调节到量气管的“0”刻度,并使两边液面相平,反应后读数时,还需要进行的操作是______.
(7)常温下测得量气管读数为67.2mL(N2的密度为1.25g/L),则实验中选用的量气管规格合适的是______(填字母序号).
A.100mLB.1LC.2L
(8)计算NaN3样品的纯度(写出计算过程).