摘要: [参考答案]NaOH.CO2.Ca(OH)2 [思维点拨]该题目考查的是物质的提纯与分离知识.要提起注意的是除去杂质的同时.不能增添其它杂质离子.更不能将需要提纯的物质消耗掉.要考虑所加药品能将杂质除去.最后还要便于分离.例如硫酸钠中的硫酸我们可用氢氧化钠.反应后产物是硫酸钠和水.将水分蒸发掉就可得到较纯净的硫酸钠.
网址:http://m.1010jiajiao.com/timu3_id_11003[举报]
运用学过的知识,按下列要求各写一个化学反应表达式(文字表达式或化学方程式):
(1)有白色固体生成的化合反应:
(2)有黑色固体生成的化合反应:
(3)有白色固体参加的分解反应:
(4)有紫色固体参加的分解反应:
查看习题详情和答案>>
(1)有白色固体生成的化合反应:
CaO+H2O=Ca(OH)2
CaO+H2O=Ca(OH)2
;(2)有黑色固体生成的化合反应:
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
;
| ||
(3)有白色固体参加的分解反应:
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
;
| ||
(4)有紫色固体参加的分解反应:
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.(答案仅供参考)
| ||
(2010?江西)小兴趣小组同学发现实验台上整齐摆放的药品中(见右下图),有一试剂瓶的标签破损.
【提出问题】这瓶试剂的成分是什么?
【讨论】根据提出问题受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是
A.酸 B.碱 C.盐
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是
【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是
A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(2)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来.他们又进行了实验.
查看习题详情和答案>>

【提出问题】这瓶试剂的成分是什么?
【讨论】根据提出问题受损标签及实验室药品分类摆放的原则,这瓶试剂不可能是
A
A
;A.酸 B.碱 C.盐
【猜想】①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是
NaCl 溶液(或Na2SO4溶液,其他答案合理均可)
NaCl 溶液(或Na2SO4溶液,其他答案合理均可)
(任写一种).【设计并实验】
(1)小明用洁净干燥的玻璃棒蘸取该溶液滴到湿润的pH试纸上,测得pH=10,他判断这是一种碱性溶液.对他的操作方法、测量结果及结论的评价,正确的是
B
B
;A.方法正确,结果正确,且结论正确 B.方法不正确,结果偏小,但结论正确
C.方法不正确,结果偏大,结论不正确 D.方法正确,结果正确,但结论不正确
(2)小明认为它是NaOH溶液,小俊认为它是Na2CO3溶液.要进一步确定它的成分,小俊认为只需选择上图已有的试剂就能把它鉴别出来.他们又进行了实验.
| 操作步骤 | 实验现象 | 结论及化学方程式 |
| 取样于试管中 向其中滴入适量的稀盐酸(或氢氧化钙溶液、氯化钙溶液) 向其中滴入适量的稀盐酸(或氢氧化钙溶液、氯化钙溶液) |
有气泡产生(或有白色沉淀生成) 有气泡产生(或有白色沉淀生成) |
猜想②正确 相关的化学方程式 Na2CO3+2HCl═2NaCl+H2O+CO2↑ (或Na2CO3+Ca(OH)2═2NaOH+ CaCO3↓、Na2CO3+CaCl2═CaCO3↓+2NaCl Na2CO3+2HCl═2NaCl+H2O+CO2↑ (或Na2CO3+Ca(OH)2═2NaOH+ CaCO3↓、Na2CO3+CaCl2═CaCO3↓+2NaCl |
9、下面观点都是错误的,请用化学式或化学方程式写出相应的否定例证.
查看习题详情和答案>>
| 错 误 观 点 | 否 定 例 证 | |
| ① | 含有氧元素的化合物一定是氧化物 | KMnO4 或 C2H5OH 或 NaOH (其他合理答案均给分). |
| ② | 生成盐和水的反应一定是中和反应 | Ca(OH)2+CO2═CaCO3↓+H2O或CuO+H2SO4═Cu SO4+H2O (其他合理答案均给分) |
某兴趣小组在复习铁的冶炼时,在参考资料上发现以下一段文字:已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2.他们不禁产生了疑问:课本上册124页的实验中,CO与Fe2O3反应生成的黑色物质真的是Fe粉吗?于是他们进行了以下探究.
[查阅资料]
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
[提出猜想]黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
[进行实验]兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
[实验结论]
(1)甲实验现象说明黑色物质中没有
(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
[拓展探究]同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
[生产流程]
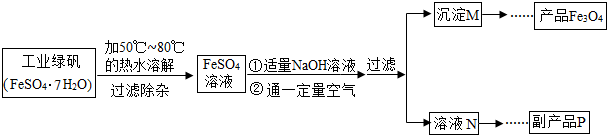
[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
资料二:Fe(OH)2受氧气氧化反应原理为:4Fe(OH)2+2H2O+O2=4Fe(OH)3
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)上述过程中,要控制“通一定量空气”的目的是
(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
[组成确定]为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
[实验设计]同学们称取了23.28g该Fe3O4样品进行了下列实验:
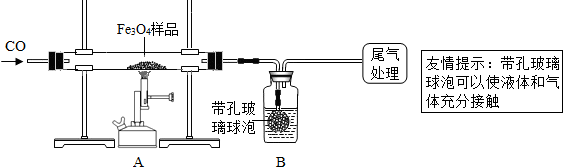
[实验分析]因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.
B中的最佳试剂是
①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用是:
①实验开始时,排尽装置中的空气,防止
②停止加热后,继续通CO气体,防止
在本实验中,CO气体还能起到的作用是③
(3)尾气如何处理?
乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图)
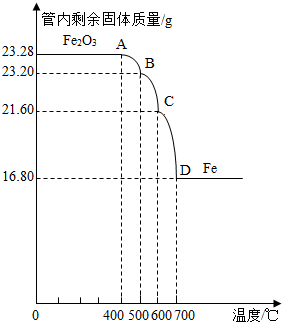
(1)写出BC段发生反应的化学方程式:
(2)通过分析计算确定:该Fe3O4样品中含有的杂质是
查看习题详情和答案>>
[查阅资料]
资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeO?Fe2O3 的形式表示;
[提出猜想]黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种.
[进行实验]兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
| 实验方案 | 实验现象 | |
| 甲 | 取少量黑色物质用磁铁吸引 | 黑色物质全部被磁铁吸引 |
| 乙 | 取少量黑色物质加入30%热的盐酸中 | 无气泡、溶液颜色变成黄绿色 |
| 丙 | 取少量黑色物质加入硫酸铜溶液中 | 无任何现象 |
(1)甲实验现象说明黑色物质中没有
FeO
FeO
,乙、丙实验现象说明黑色物质中没有Fe
Fe
;(2)生成的黑色物质应为Fe3O4;
(3)写出黑色粉末和热的盐酸反应的化学方程式
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
;[拓展探究]同学们对Fe3O4产生了兴趣,从参考资料中找到了氧化沉淀法生产复印用高档Fe3O4粉的工艺流程简图.
[生产流程]

[查阅资料]
资料一:硫酸亚铁在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
资料三:获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
[问题讨论]
(1)溶解时,用50℃至80℃的热水目的是
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率
.(2)写出加入适量NaOH溶液时发生反应的化学方程式
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
2NaOH+FeSO4═Fe(OH)2↓+Na2SO4
.(3)上述过程中,要控制“通一定量空气”的目的是
控制Fe(OH)2转化为Fe(OH)3的量
控制Fe(OH)2转化为Fe(OH)3的量
.(4)要使四氧化三铁的产率最高,则上述流程中产生的Fe(OH)2和Fe(OH)3的最佳质量比为
90:214
90:214
.(5)副产品P是硫酸钠,由溶液N获得该副产品的操作顺序是b→
c
c
→a
a
→d.a.过滤 b.加热浓缩 c.冷却结晶 d.晶体加热至完全失去结晶水
[组成确定]为确定用以上方法制得的四氧化三铁中可能含有的杂质,同学们又进行了下列实验探究.
[查阅资料]
资料一:难溶性碱受热时能分解产生金属氧化物和水(反应中各种元素的化合价不变);
资料二:Fe2O3和CO反应是随温度升高而逐步进行的,先生成Fe3O4,再生成FeO(黑色),最后生成Fe;
[提出猜想]Fe3O4中可能含有的杂质是Fe2O3和FeO中的一种或两种.
[实验设计]同学们称取了23.28g该Fe3O4样品进行了下列实验:

[实验分析]因探究思路不同,兴趣小组分成甲、乙两小组.
甲组:
(1)该组同学欲通过B装置反应前后的质量变化来计算确认该Fe3O4样品中的杂质.
B中的最佳试剂是
②
②
(填序号)①澄清石灰水 ②氢氧化钠浓溶液 ③稀盐酸 ④水
(2)上述实验过程中,CO气体除作为反应物外,能起到的作用是:
①实验开始时,排尽装置中的空气,防止
防止爆炸
防止爆炸
;②停止加热后,继续通CO气体,防止
防止生成物被氧化
防止生成物被氧化
,以及B中的溶液倒吸入A中;在本实验中,CO气体还能起到的作用是③
让二氧化碳全部进入B瓶中
让二氧化碳全部进入B瓶中
.(3)尾气如何处理?
点燃
点燃
.乙组:
利用仪器测定并绘制成反应过程中A装置中玻璃管内的固体质量随温度的变化曲线(如图)

(1)写出BC段发生反应的化学方程式:
Fe3O4+CO
3FeO+CO2
| ||
Fe3O4+CO
3FeO+CO2
;
| ||
(2)通过分析计算确定:该Fe3O4样品中含有的杂质是
Fe2O3
Fe2O3
.(不需要写过程)
走进实验室,如果细心观察会有很多发现.小明就是这样一个很细心,善于提问,肯钻研的学生,以下是他记录的几个问题:
(1)有些玻璃仪器要经磨砂处理,而且磨砂部位不尽相同,如集气瓶磨砂面在瓶口的平面,而滴瓶磨砂面在颈部内壁,为什么?
(2)盛NaOH溶液的细口瓶上配的是橡皮塞,而装稀盐酸、稀硫酸的瓶子盖的是玻璃塞,为什么?
(3)硝酸银溶液盛放在棕色瓶中,为什么不用普通透明玻璃瓶盛放?
第1个问题,他认真思考后明白了,请帮助写下答案 .
后二个问题,他查阅资料,请教老师,知道了装NaOH溶液的瓶口如果盖玻璃塞,一段时间后,塞子与细口瓶粘连在一起,不易打开,因为玻璃中含有一种叫二氧化硅的物质,与CO2属同一类物质,请用化学方程式解释不易打开的原因并猜测生成物具有的性质 、 .
硝酸银溶液不稳定,在先照的条件下易分解,生成二氧化氮和氧气及一种单质,所以必须存放在棕色瓶中,写出此反应的化学方程式 .
查看习题详情和答案>>
(1)有些玻璃仪器要经磨砂处理,而且磨砂部位不尽相同,如集气瓶磨砂面在瓶口的平面,而滴瓶磨砂面在颈部内壁,为什么?
(2)盛NaOH溶液的细口瓶上配的是橡皮塞,而装稀盐酸、稀硫酸的瓶子盖的是玻璃塞,为什么?
(3)硝酸银溶液盛放在棕色瓶中,为什么不用普通透明玻璃瓶盛放?
第1个问题,他认真思考后明白了,请帮助写下答案
后二个问题,他查阅资料,请教老师,知道了装NaOH溶液的瓶口如果盖玻璃塞,一段时间后,塞子与细口瓶粘连在一起,不易打开,因为玻璃中含有一种叫二氧化硅的物质,与CO2属同一类物质,请用化学方程式解释不易打开的原因并猜测生成物具有的性质
硝酸银溶液不稳定,在先照的条件下易分解,生成二氧化氮和氧气及一种单质,所以必须存放在棕色瓶中,写出此反应的化学方程式