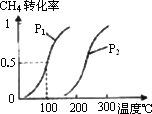
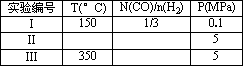
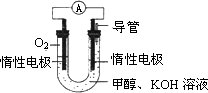
0 92426 92434 92440 92444 92450 92452 92456 92462 92464 92470 92476 92480 92482 92486 92492 92494 92500 92504 92506 92510 92512 92516 92518 92520 92521 92522 92524 92525 92526 92528 92530 92534 92536 92540 92542 92546 92552 92554 92560 92564 92566 92570 92576 92582 92584 92590 92594 92596 92602 92606 92612 92620 203614