|
1.92 g铜投入一定量浓度HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672 mL气体(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是 | |
| [ ] | |
A. |
504 mL |
B. |
168 mL |
C. |
336 mL |
D. |
224 mL |
|
将1.92 g铜粉与一定量浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况).则消耗硝酸的物质的量是 | |
| [ ] | |
A. |
0.12 mol |
B. |
0.11 mol |
C. |
0.09 mol |
D. |
0.08 mol |
|
把a L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用b mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗c mol BaCl2,则原溶液中c( | |
| [ ] | |
A. |
|
B. |
|
C. |
|
D. |
|
|
若以w1和w2分别表示浓度为a mol·L-1和b mol·L-1的氨水的质量分数,且知2a=b,则下列推断正确的是(氨水密度比纯水小) | |
| [ ] | |
A. |
2w1=w2 |
B. |
2w2=wω1 |
C. |
2w1<w2 |
D. |
w1<w2<2w1 |
|
在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器中内,充分反应后,容器内残留m/2体积的气体,该气体与空气接触后变为红棕色.则m和n的比值为 | |
| [ ] | |
A. |
3∶2 |
B. |
2∶3 |
C. |
8∶3 |
D. |
3∶8 |
|
将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%、Cu:64.3%,在上述反应中SO2的作用是 | |
| [ ] | |
A. |
作为酸 |
B. |
作为漂白剂 |
C. |
作为还原剂 |
D. |
作为氧化剂 |
|
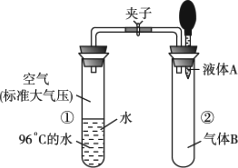
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了.则液体A和气体B的组合不可能是下列的
| |
| [ ] | |
A. |
氢氧化钠溶液、二氧化碳 |
B. |
水、氨气 |
C. |
氢氧化钠溶液、一氧化氮 |
D. |
水、二氧化氮 |
|
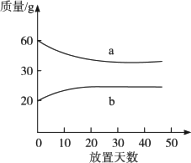
浓硫酸和2 mol·L-1的稀硫酸,在实验室中敞口放置,它们的质量和放置天数的关系如下图.分析a、b曲线变化的原因是
| |
| [ ] | |
A. |
a升华、b冷凝 |
B. |
a吸水、b挥发 |
C. |
a蒸发、b潮解 |
D. |
a冷凝、b吸水 |