|
在分开盛放的M、N两溶液中,各含下列十四种离子中的七种:Al3+、Na+、K+、Fe3+、NH4+、H+、Cl-、NO3-、OH-、S2-、MnO4-、SO42-、AlO2-、CO32-,且两溶液里所含离子不相同,已知M溶液中的阳离子只有两种,则N溶液中的阴离子应该是 | |
| [ ] | |
A. |
NH4+ S2- CO32- |
B. |
MnO4- SO42- NO3- |
C. |
NO3- Cl- SO42- |
D. |
AlO2- SO42- MnO4- |
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
漂白粉溶液通入足量的CO2:Ca2++2ClO-+CO2+H2O |
B. |
含3 mol FeCl2和1 mol NaI混合溶液中加入1 mol Cl2:2I-+Cl2 |
C. |
在Mg(HCO3)2溶液中加入过量NaOH溶液:Mg2++2HCO3-+4OH- |
D. |
FeSO4 溶液中加H2O2溶液:Fe2++2H2O2+4H+ |
|
下列反应的离子方程式中,不正确的是 | |
| [ ] | |
A. |
澄清石灰水加入少量小苏打溶液:Ca2++OH-+HCO |
B. |
AlCl3 溶液中加入过量氨水:Al3++3NH3·H2O |
C. |
Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++2OH-+2H++SO |
D. |
用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O |
|
用NA表示阿伏加德罗常数的值.下列叙述正确的是 | |
| [ ] | |
A. |
17 g甲基(-14CH3)所含中子数为9 NA |
B. |
1 mol C10H22分子中共价键总数为32 NA |
C. |
标准状况下,密度为ρg·L-1的某气体纯净物一个分子的质量为 |
D. |
常温下,0.2 mol Cl2溶于等体积水中,转移电子数为0.2 NA |
|
下列离子方程式中,不正确的是 | |
| [ ] | |
A. |
Na2S溶液中通入适量H2S:S2-+H2S |
B. |
氧化铁溶于氢碘酸:Fe2O3+6H+ |
C. |
过量铁粉加入稀HNO3溶液中:3Fe+8H++2NO |
D. |
NaHSO3溶液显酸性的原因:HSO |
|
已知: ①硫酸比次氯酸稳定 ②硫酸的酸性弱于高氯酸 ③H2S比HCl易被氧化 ④HCl比H2S更容易由单质合成 ⑤盐酸的酸性比氢硫酸强. ⑥硫不溶于水,而氯气溶于水 ⑦通常状态下硫为淡黄色晶体,而氯气为黄绿色气体 ⑧在与金属形成的化合物中硫为-2价,而氯为-1价 ⑨在跟同一金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态.上述事实能说明硫的非金属性比氯弱的是 | |
| [ ] | |
A. |
②③④⑨ |
B. |
③④⑤⑦⑧⑨ |
C. |
②③④⑧⑨ |
D. |
①③⑤⑧ |
|
用惰性电极电解一定量的硫酸铜溶液,通电一段时间后,向电解后的溶液中加入0.1 mol Cu(OH)2固体,恰好能使硫酸铜溶液恢复原来的浓度和质量,则在电解过程中转移的电子的物质的量为 | |
| [ ] | |
A. |
0 .2 mol |
B. |
0 .4 mol |
C. |
0 .5 mol |
D. |
0 .6 mol |
|
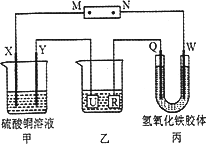
如下图所示,X、Y、Q、W 都是惰性电极,将电源接通后,W极附近颜色逐渐加深.下列说法中错误的是
| |
| [ ] | |
A. |
电源的M极为正极 |
B. |
甲装置中溶液的pH减小 |
C. |
甲装置的两个电极上都有单质生成且物质的量之比为1∶1 |
D. |
欲用乙装置给铜镀银,U极应该是Ag,电镀液选择AgNO3溶液 |
|
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为 | |
| [ ] | |
A. |
0.1 mol |
B. |
0.2 mol |
C. |
0.3 mol |
D. |
0.4 mol |
|
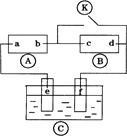
下图 下列叙述错误的是
| |
| [ ] | |
A. |
a为直流电源的正极 |
B. |
c极发生的反应为2H++2e-=H2↑ |
C. |
f电极为锌板 |
D. |
e极发生氧化反应 |