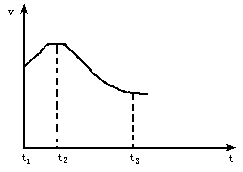
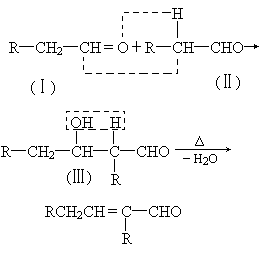
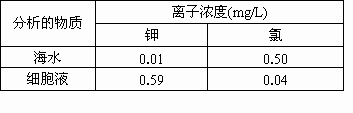
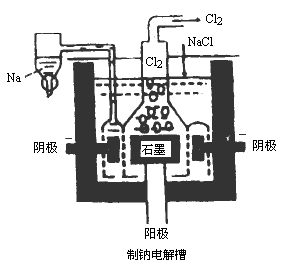
0 87945 87953 87959 87963 87969 87971 87975 87981 87983 87989 87995 87999 88001 88005 88011 88013 88019 88023 88025 88029 88031 88035 88037 88039 88040 88041 88043 88044 88045 88047 88049 88053 88055 88059 88061 88065 88071 88073 88079 88083 88085 88089 88095 88101 88103 88109 88113 88115 88121 88125 88131 88139 203614