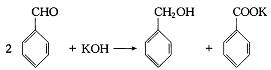
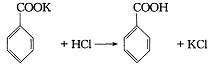
已知下列数据:
0 87296 87304 87310 87314 87320 87322 87326 87332 87334 87340 87346 87350 87352 87356 87362 87364 87370 87374 87376 87380 87382 87386 87388 87390 87391 87392 87394 87395 87396 87398 87400 87404 87406 87410 87412 87416 87422 87424 87430 87434 87436 87440 87446 87452 87454 87460 87464 87466 87472 87476 87482 87490 203614
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
|
浓H2SO4 |
|
338 |
1.84 |
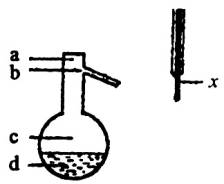
实验室制乙酸乙酯的主要装置如下图(a)所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按(a)图连接装置,使产生的蒸气经导管通到15ml试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处;
③小火加热试管中的混合液;
④待小试管中收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是
(2)写出该反应的化学方程式________,浓H2SO4的作用是________。
(3)步骤③中,用小火加热试管中的混合液,其原因是________。
(4)步骤④所观察到的现象是________,写出原因与结论:________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从________口倒出,因为________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答________。