|
通过复习总结,你认为下列对化学知识概括合理的组合是 ①能与酸反应的氧化物,一定是碱性氧化物 ②原子晶体、金属晶体、分子晶体中都一定存在化学键 ③原子晶体熔点不一定比金属晶体高 ④在熔化状态和水溶液中均不能导电的物质称为非电解质 ⑤NF3的沸点比NH3的沸点低是因为N-F比N-H键的键能大 ⑥过氧化氢和液氮的分子中都有非极性共价键 | |
A. |
只有①②⑥ |
B. |
只有③④ |
C. |
只有③⑥ |
D. |
只有⑤⑥ |
|
X、Y、Z为短周期元素,X的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子的最外层电子数比Y多3.下列叙述正确的是 | |
A. |
离子半径的大小顺序:Z>X>Y |
B. |
Z单质与X单质直接反应可生成两种化合物 |
C. |
工业上,电解X和Y形成的化合物制取Y单质 |
D. |
Y、Z元素的最高价氧化物的水化物不能互相反应 |
|
下列说法正确的是(NA为阿伏加德罗常数) | |
A. |
124 g P4含有P-P键的个数为4NA |
B. |
18 g NH4+中含有N-H键键长和键能均相同,且个数为4NA |
C. |
12 g金刚石中含有C-C键的个数为2NA |
D. |
60 g SiO2中含Si-O键的个数为2NA |
|
相同容积的4个密闭容器中进行同样的可逆反应:2A(g)+B(g)
在相同温度下建立平衡时,A或B的转化率大小关系为 | |
A. |
A的转化率为:甲<乙<丙<丁 |
B. |
A的转化率为:甲<丙<乙<丁 |
C. |
B的转化率为:甲>乙>丙>丁 |
D. |
B的转化率为:丁>乙>丙>甲 |
|
对于平衡体系mA(g)+nB(g) | |
A. |
若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q |
B. |
若平衡时A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n |
C. |
若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol |
D. |
若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小 |
|
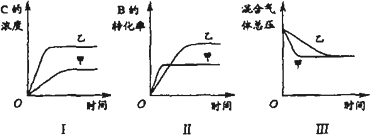
在容积固定的密闭容器中存在如下反应:A(g)+3B(g)
下列判断正确的是 | |
A. |
图I研究的是不同催化剂对反应的影响,且乙使用的催化剂效率较高 |
B. |
图Ⅱ研究的是压强对反应的影响,且甲的压强较高 |
C. |
图Ⅱ研究的是温度对反应的影响,且甲的温度较高 |
D. |
图Ⅲ研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
|
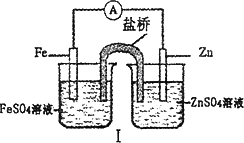
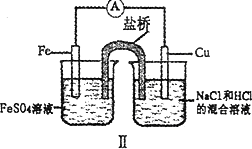
综合下图判断,下列正确的说法是
| |
A. |
装置Ⅰ和装置Ⅱ中负极反应均是Fe-2e-=Fe2+ |
B. |
装置Ⅰ和装置Ⅱ中正极反应均是O2+4e-+2H2O |
C. |
装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动 |
D. |
放电过程中,装置Ⅱ右侧烧杯中溶液的pH增大 |
|
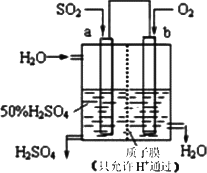
科研人员设想用如图所示装置生产硫酸,下列说法正确的是
| |
A. |
a为正极,b为负极 |
B. |
生产过程中H+向a电极区域运动 |
C. |
电子从b极向a极移动 |
D. |
负极反应式为:2H2O+SO2-2e-=SO |
|
以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应为: 4NH3+3O2 有关下列说法错误的是 | |
A. |
氨燃料电池在放电时,氨气被氧化 |
B. |
氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-N2+6H2O |
C. |
以氨气代替氢气的主要原因是:氨气易液化易储存 |
D. |
燃料电池的能量转化率一般比普通的电池高 |
|
某种电池的总反应为Fe+NiO2+2H2O | |
A. |
放电时Fe是负极,NiO2是正极 |
B. |
放电时正极反应是:NiO2+H2O+2e-=Ni(OH)2+2OH- |
C. |
放电时负极反应为:Fe-2e-+2OH-=Fe(OH)2 |
D. |
该蓄电池的电极应该浸入某种碱性电解质溶液中 |