|
盐酸、醋酸和碳酸氢钠是生活中常见的物质.下列表述正确的是 | |
A. |
在NaHCO3溶液中加入与其等物质的量的NaOH,溶液中的阴离子只有CO32-和OH- |
B. |
NaHCO3溶液中:c(HCO3-)+c(H2CO3)+c(CO32-)=c(Na+) |
C. |
相同温度下,10 mL 0.1 mol·L-1的醋酸与100 mL 0.01 mol·L-1的醋酸中的H+物质的量不相等 |
D. |
中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
|
短周期元素A、B、C的原子序数依次增大,它们的原子最外层电子数之和为10,A与C同主族,B原子的最外层电子数等于A原子的次外层电子数,则下列叙述正确的是 | |
A. |
原子半径:A<B<C |
B. |
C的单质可以作为半导体材料 |
C. |
三种元素的最高价氧化物对应的水化物均可由化合反应得到 |
D. |
高温下,A单质能置换出C单质 |
|
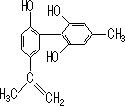
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是
| |
A. |
该物质遇FeCl3溶液显紫色 |
B. |
滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键 |
C. |
1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4 mol、7 mol |
D. |
该分子中的所有原子有可能共平面 |
|
某有机物的结构简式为 ①含酚羟基,遇FeCl3溶液显紫色 ②结构中的酚羟基、醇羟基、羧基均能与金属钠反应,1 mol该有机物能与3 mol钠反应 ③含有羧基,1 mol该有机物与1 mol NaHCO3反应 ④能与羧酸发生酯化反应,也能与醇酯化反应,也可以进行分子内酯化反应 ⑤能与Cu(OH)2发生反应,该有机物1 mol与2.5 mol Cu(OH)2反应 上述说法错误的是 | |
A. |
只有② |
B. |
只有④ |
C. |
只有⑤ |
D. |
全部正确 |
|
下列关于电解质溶液的叙述正确的是 | |
A. |
常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
B. |
10 mL 0.1 mol/LNH4Cl溶液5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) |
C. |
相同温度和浓度的钾盐溶液中,酸式盐的pH一定小于正盐的pH |
D. |
常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
|
下列反应的离子方程式书写正确的是 | |
A. |
饱和石灰水与稀硝酸反应:Ca(OH)2+2H+ |
B. |
稀硫酸与锌反应:H2SO4+Zn |
C. |
碳酸钙与稀盐酸反应:CaCO3+2H+ |
D. |
小苏打溶液与NaOH反应:HCO |
|
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中错误的是
| |
A. |
反应的化学方程式为:2N |
B. |
t 3时,正反应速率大于逆反应速率 |
C. |
t 1时,N的浓度是M浓度的2倍 |
D. |
t 2时,正逆反应速率相等,达到平衡 |
|
关于NaHCO3溶液的表述正确的是 | |
A. |
c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
B. |
c(Na+)+c(H+) |
C. |
HCO3-的电离程度大于HCO3-的水解程度 |
D. |
存在的电离平衡有:HCO3- |
|
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量为 | |
A. |
|
B. |
(a-b)mol |
C. |
|
D. |
(a+b)mol |
|
将一定量的NaOH和NaHCO3的混合物X放在密闭容器中加热,充分反应后生成V1 L气体Z(V1≠0).反应后的固体残渣Y与过量的稀盐酸反应,又生成V2 L气体Z(V1、V2均为标准状况下气体的体积).下列判断错误的是 | |
A. |
Y的成分为Na2CO3 |
B. |
Z的成分为CO2 |
C. |
V1>V2 |
D. |
X中n(Na+)= |
 ,其性质有下列说法:
,其性质有下列说法: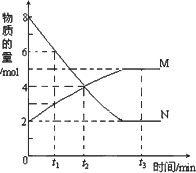
 M
M