|
下列反应的离子方程式正确的是 | |
A. |
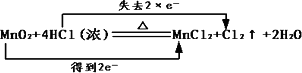
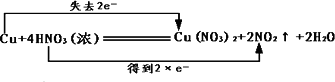
单质铜与稀硝酸反应:Cu+2H++2NO3-=Cu2++2NO↑+H2O |
B. |
向Fe(NO3)2溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
C. |
碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
D. |
氨气通入醋酸溶液 CH3COOH+NH3=CH3COONH4 |
|
最近意大利罗马大学的科学家获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1 mol N-N吸收167 kJ热量,生成1 mol N≡N放出942 kJ热量,根据以上信息和数据,下列说法正确的是
| |
A. |
N4属于一种新型的化合物 |
B. |
N4与N2互称为同位素 |
C. |
N4化学性质比N2稳定 |
D. |
1 mol N4气体转变为N2将放出882 kJ热量 |
|
下列说法正确的是 ①用25 mL酸式滴定管可以准确放出8.00 mL的稀盐酸; ②可用干燥的pH试纸测定氯水的pH; ③使用容量瓶配制溶液,定容时俯视,所得溶液的浓度偏大; ④加入盐酸有使澄清石灰水变浑浊的无色气体生成,则原溶液中一定有大量CO ⑤在某温度下,醋酸与氢氧化钠溶液混合,溶液呈碱性,溶液中离子浓度大小的关系一定为:c(Na+)>c(CH3COO-)>c(OH-)>c(H+); ⑥下图是反应物和生成物的能量示意图,其可能发生反应的热化学方程式:2A(g)+B(g)
| |
A. |
①③⑥ |
B. |
②④⑤ |
C. |
①③④ |
D. |
③⑤⑥ |
|
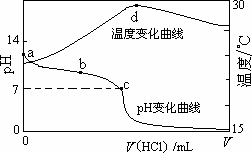
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示.下列有关说法正确的是
| |
A. |
a点由水电离出的c(H+)=1.0×10-14 mol/L |
B. |
b点:c(NH4+)+c(NH3·H2O)=c(Cl-) |
C. |
c点:c(Cl-)=c(NH4+) |
D. |
d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热 |
|
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是 | |
A. |
正极反应式:Ag+Cl--e-=AgCl |
B. |
每生成1 mol Na2Mn5O10转移2 mol电子 |
C. |
Na+不断向“水”电池的负极移动 |
D. |
AgCl是还原产物 |
|
短周期元素W、X、Y、和Z的原子序数依次增大.元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是 | |
A. |
元素W、X的氯化物中,各原子均满足8电子的稳定结构 |
B. |
元素X与氢形成的原子比为1∶1的化合物有很多种 |
C. |
元素Y的单质与氢氧化钠溶液或盐酸溶液反应均有氢气生成 |
D. |
元素Z可与元素X形成共价化合物XZ2 |
|
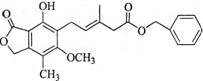
有关下图所示化合物的说法不正确的是
| |
A. |
既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应 |
B. |
1 mol该化合物最多可以与3 mol NaOH反应 |
C. |
既可以催化加氢,又可以使酸性KMnO4溶液褪色 |
D. |
既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 |
|
某食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水: ①加入稍过量的Na2CO3溶液; ②加入稍过量的NaOH溶液; ③加入稍过量的BaCl2溶液; ④滴入稀盐酸至无气泡产生; ⑤过滤 正确的操作顺序是 | |
A. |
③②①⑤④ |
B. |
①②③⑤④ |
C. |
②③①⑤④ |
D. |
③⑤②①④ |