|
己知维生素A的结构简式可写为 | |
A. |
维生素A的分子式为C20H32O |
B. |
维生素A 能使溴的四氯化碳溶液褪色 |
C. |
1 mol该有机物 能跟1 mol金属Na反应 |
D. |
1 mol维生素A在催化剂作用下最多可与7 mol H2发生加成反应 |
|
已知四种短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同电子层结构,则下列叙述不正确的是 | |
A. |
原子半径B>A>C>D |
B. |
最高价氧化物水化物的碱性B>A |
C. |
离子半径C3->D->B+>A2+ |
D. |
氢化物的稳定性C>D |
|
Li-Al/FeS电池是一种正在开发的车载电 2Li++FeS+2e- | |
A. |
该电池的电池反应式为:2Li+FeS |
B. |
Li-Al合金在电池中作为正极材料 |
C. |
负极的电极反应式为:Al-3e- |
D. |
Li-Al/FeS电池中,电子经外电路流入Li-Al极 |
|
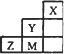
如下图,先向B中充入2 mol X、2 mol Y,关闭活塞K,再向A充入1 mol X、1 mol Y,使起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,两容器中各自发生下述反应,X(g)+Y(g)
| |
A. |
反应速率:v(B)>v(A) |
B. |
A容器中X的转化率为80% |
C. |
A中混合气体密度不再变化能够证明A中反应达到平衡状态 |
D. |
B中混合气体密 |
|
主族元素X、Y、Z的离子为aX+、bY2-、cZ-,半径大小关系是aX+<cZ-<bY2-下列说法错误的是 | |
A. |
b一定小于c |
B. |
单质的还原性X>Z |
C. |
Y2-的还原性大于Z- |
D. |
X可位于Y的上一周期、下一周期或同周期 |
|
在元素周期表主族元素中.甲元素与乙、丙、丁三元素紧密相邻.甲、乙的原子序数之和等于丙的原子序数.这四种元素原子的最外层电子数之和为20.下列判断正确的是 | |
A. |
原子半径:丙>乙>甲>丁 |
B. |
丁或甲与乙所形成的化合物都是有毒的物质 |
C. |
最高价氧化物的对应水化物的酸性:丁>甲 |
D. |
气态氢化物的稳定性:甲>丙 |
|
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应: H2(g)+Br2(g)
下列说法正确的是 | |
A. |
由图可知:T2>T1 |
B. |
两点的反应速率:a>b |
C. |
T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
D. |
a点比b点体系的颜色深 |
|
下列事实不能用勒沙特列原理解释的是 | |
A. |
合成氨反应:N2(g)+3H2(g) |
B. |
对2HI(g) |
C. |
使用催化剂有利于提高 SO2与O2生成SO3的效率 |
D. |
用排饱和氯化钠溶液的方法来收集氯气 |
|
在密闭容中发生下列反应aA(g) | |
A. |
A的转化率变小 |
B. |
平衡向正反应方向移动 |
C. |
D的体积分数变大 |
D. |
a<c+d |
 Li2S+Fe,有关该电池的下列叙述中正确的是
Li2S+Fe,有关该电池的下列叙述中正确的是 Li2S+Fe
Li2S+Fe 2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错的是
2Z(g)+W(g);A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错的是
 2HBr(g);ΔH<0.当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.
2HBr(g);ΔH<0.当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.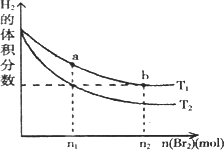
 2NH3(g);ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施
2NH3(g);ΔH<0,为使氨的产率提高,理论上应采取低温高压的措施 H2(g)+I2(g)平衡体系增加压强使颜色变深
H2(g)+I2(g)平衡体系增加压强使颜色变深 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是