|
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体.现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色.对于原混合气体成分的判断中正确的是 | |
A. |
肯定有SO2和NO |
B. |
可能有SO2、O2和NO |
C. |
可能有Cl2和O2 |
D. |
Cl2和SO2至少有一种、肯有NO |
|
下列离子方程式书写正确的是 | |
A. |
铝粉投入氢氧化钠溶液中:2Al+2OH- |
B. |
氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O |
C. |
氯化铁溶液中加入铁粉:Fe3++Fe |
D. |
碳酸钙与盐酸反应:CO |
|
设NA表示阿伏加德罗常数的值,下列叙述中正确的是 | |
A. |
常温常压下,48 g O3含有的氧原子数为3 NA |
B. |
1.8 g的NH |
C. |
常温常压下,11.2 L氧气所含的原子数为NA |
D. |
2.4 g金属镁变为镁离子时失去的电子数为0.1 NA |
|
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
| |
A. |
X的气态氢化物比Y的稳定 |
B. |
W的最高价氧化物对应水化物的酸性比Z的强 |
C. |
Z的非金属性比Y的强 |
D. |
X与Y形成的化合物都易溶于水 |
|
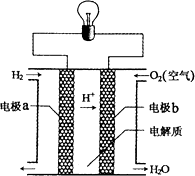
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图.下列有关氢氧燃料电池的说法正确的是
| |
A. |
该电池工作时电能转化为化学能 |
B. |
该电池中电极a是正极 |
C. |
外电路中电子由电极b通过导线流向电极a |
D. |
该电池的总反应:2H2+O2=2H2O |
|
向100 mL 0.2 mol/L的NaOH溶液中通入标准状况下的CO2 448 mL,则最终溶液中微粒间关系不正确的是(假设气体完全吸收并忽略反应前后溶液体积的变化) | |
A. |
c(Na+)+c(H+)=c(HCO |
B. |
c(H+)+c(H2CO3)-c(CO |
C. |
c(Na+)>c(HCO |
D. |
c(HCO |
|
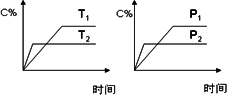
可逆反应aA(s)+bB(g)
| |
A. |
达到平衡后,加入催化剂则C%增大 |
B. |
达到平衡后,若升高温度,平衡向左移动 |
C. |
化学方程式中的b<c+d |
D. |
达平衡后,增加A的量,有利于平衡向右移动 |
|
常温下,某无色溶液中投入金属铝会产生大量无色易燃气体,则该溶液中 | |
A. |
可能含较多CO |
B. |
可能含较多NO |
C. |
可能水电离出的c(H+)=1×10-12 mol/L |
D. |
可能含较多MnO |
|
下列离子方程式书写正确的是 | |
A. |
在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-=AgI↓ |
B. |
将少量浓FeCl3溶液滴入沸水中:Fe3++3H2O=Fe(OH)3↓+3H+ |
C. |
明矾溶液中滴加Ba(OH)2溶液至SO |
D. |
向Ca(ClO)2溶液中通入足量CO2气体:ClO-+CO2+H2O=HCO |
|
将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产生全是NO,向所得溶液中加入物质的量浓度为3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中不正确的是 | |
A. |
开始加入合金的质量可能为6.4 g |
B. |
参加反应的硝酸的物质的量为0.4 mol |
C. |
生成沉淀完全时消耗NaOH溶液的体积为100 mL |
D. |
溶解合金时收集到NO气体的体积为2.24 L |
 2AlO
2AlO Al(OH)3↓+3NH
Al(OH)3↓+3NH 2Fe2+
2Fe2+ CO2↑+H2O
CO2↑+H2O