|
若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是 | |
A. |
NH4+ NO3- CO32- Na+ |
B. |
Na+ Ba2+ Mg2+ HCO3- |
C. |
NO3 - Ca2+ K+ Cl- |
D. |
NO3 - K+ AlO2- OH- |
|
在恒容的密闭容器中充入2 mol A和1 mol B的气体后发生反应2A(g)+B(g) | |
A. |
1 |
B. |
2 |
C. |
3 |
D. |
4 |
|
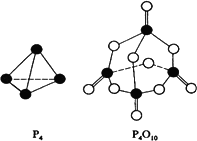
白磷与氧可发生如下反应:P4+5O2=P4O10已知断裂下列化学键需要吸收的能量分别为: P-PakJ·mol-1、P-ObkJ·mol-1、P=OckJ·mol-1、O=OdkJ·mol-1.根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是
| |
A. |
(6a+5d-4c-12b)kJ·mol-1 |
B. |
(4c+12b-6a-5d)kJ·mol-1 |
C. |
(4c+12b-4a-5d)kJ·mol-1 |
D. |
(4a+5d-4c-12b)kJ·mol-1 |
|
可逆反应2A+B
| |
A. |
A和B可能都是固体 |
B. |
A和B一定都是气体 |
C. |
若B为固体,则A一定是气体 |
D. |
A和B可能都是气体 |
|
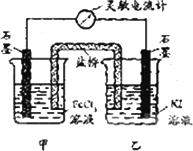
控制适合的条件,将反应2Fe3++2I-
| |
A. |
反应开始时,乙中石墨电极上发生氧化反应 |
B. |
反应开始时,甲中石墨电极上Fe3+被还原 |
C. |
电流计读数为零时,反应达到化学平衡状态 |
D. |
电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极 |
|
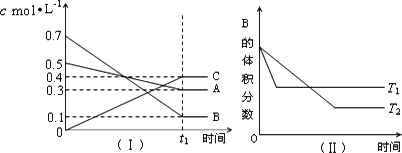
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是
| |
A. |
在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
B. |
(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 |
C. |
T ℃时,在相同容器中,若由0.3 mol·L-1 A,0.1 mol·L-1 B,和0.4 mol·L-1 C反应,达到平衡后C的浓度仍为0.4 mol·L-1 |
D. |
其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
|
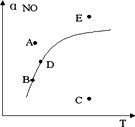
在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)
| |
A. |
A或E |
B. |
B点 |
C. |
C点 |
D. |
D点 |
|
氢氧燃料电池以H2为还原剂,O2为氧化剂,电极为多孔镍,电解液为30%的KOH溶液,下列有关叙述正确的是 ①负极反应为4OH――4e ②负极反应H2+2OH--2e=2H2O ③工作时正极区PH升高,负极区PH降低 ④工作时溶液中阴离子移向正极 | |
A. |
③④ |
B. |
②③ |
C. |
②④ |
D. |
①④ |
|
已知H2(g)+Br2(1)=2HBr(g);ΔH=-72 kJ/mol蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
则表中a为 | |
A. |
404 |
B. |
260 |
C. |
230 |
D. |
200 |