|
在一密闭容器中,反应aA(g) | |
A. |
平衡向正反应方向移动了 |
B. |
物质A的转化率增大了 |
C. |
物质B的质量分数增加了 |
D. |
a>b |
|
如果定义有机物的同系列是一系列结构式符合A[W]nB(其中n=0,1,2,3……)的化合物.式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差.同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是 | |
A. |
CH3CH2CH2CH3 CH3CH2CH2CH2CH3 CH3CH2CH2CH2CH2CH3 |
B. |
CH3CH |
C. |
CH3CH2CH3 CH3CHClCH2CH3 CH3CHClCH2CHClCH3 |
D. |
ClCH2CHClCCl3 ClCH2CHClCH2CHClCCl3 ClCH2CHClCH2CHClCH2CHClCCl3 |
|
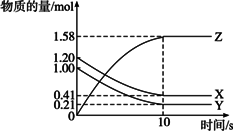
某温度时,在2 L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均速率分别为
| |
A. |
X+Y |
B. |
X+Y |
C. |
X+2Y |
D. |
X+3Y |
|
将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) | |
A. |
用物质A表示的反应的平均速率为0.6 mol·L-1·s-1 |
B. |
用物质B表示的反应的平均速率为0.3 mol·L-1·s-1 |
C. |
2 s时物质A的转化率为70% |
D. |
2 s时物质B的浓度为0.7 mol·L-1 |
|
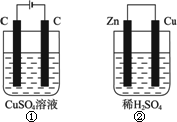
如下图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是
| |
A. |
产生气体的体积:①>② |
B. |
电极上析出物质的质量:①>② |
C. |
溶液的pH变化:①增大,②减小 |
D. |
电极反应式①中阳极:4OH--4e |
|
把a、b、c、d四块金属浸泡在稀硫酸中,用导线两两相连可以组成各种原电池:若a、b相连,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极.则这四种金属的活动性顺序由大到小为 | |
A. |
a>b>c>d |
B. |
a>c>d>b |
C. |
c>a>b>d |
D. |
b>d>c>a |
|
氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池.氢镍电池的总反应式是 | |
A. |
电池放电时,电池负极周围溶液的pH不断增大 |
B. |
电池放电时,镍元素被氧化 |
C. |
电池充电时,氢元素被还原 |
D. |
电池放电时,H2是负极 |
|
实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: 负极:PB+SO 正极:PBO2+4H++SO 今若制得Cl2 0.050 mol,这时电池内消耗的H2SO4的物质的量至少是 | |
A. |
0.025 mol |
B. |
0.050 mol |
C. |
0.10 mol |
D. |
0.20 mol |
|
某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得容器中各物质的浓度分别为c(X2)=0.4 mol·L-1,c(Y2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1,则该反应的反应式可表示为 | |
A. |
X2+2Y2 |
B. |
2X2+Y22 |
C. |
3X2+Y2 |
D. |
X2+3Y2 |