|
在一密闭容器中,可逆反应aA(g)+bB(g) | |
A. |
平衡向正反应方向移动 |
B. |
物质A的转化率降低了 |
C. |
物质C的质量分数增加了 |
D. |
a+b>c |
|
如图表示外界条件(温度、压强)的变化对下列反应的影响:L(s)+G(g)
| |
A. |
平衡混合气中R的质量分数 |
B. |
平衡混合气中G的质量分数 |
C. |
G的转化率 |
D. |
L的转化率 |
|
在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+2B(g) | |
A. |
混合气体的压强 |
B. |
混合气体的密度 |
C. |
B的物质的量浓度 |
D. |
气体的总物质的量 |
|
反应4NH3+5O2 | |
A. |
|
B. |
|
C. |
|
D. |
|
|
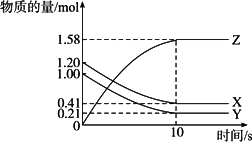
一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是
| |
A. |
反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1 |
B. |
反应开始时10 s,X的物质的量浓度减少了0.79 mol·L-1 |
C. |
反应开始时10 s,Y的转化率为79.0% |
D. |
反应的化学方程式为:X(g)+Y(g) |
|
已知氢化锂(LiH)属于离子化合物.LiH跟水反应可以放出氢气.下列叙述中正确的是 | |
A. |
LiH的水溶液显中性 |
B. |
LiH中的氢离子可以被还原成氢气 |
C. |
LiH是一种强氧化剂 |
D. |
LiH中氢离子比锂离子的半径大 |
|
A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是(a-b),L层电子数是(a+b),则A、B两种元素形成的化学式可能表示为 | |
A. |
B3A2 |
B. |
BA2 |
C. |
A3B2 |
D. |
AB2 |
|
在主族元素X、Y、Z中,X与Y两元素的原子核外电子层数相同;X的原子半径大于Y的原子半径,X与Z两原子的阳离子具有相同的电子层结构,Z的离子半径大于X的离子半径,则X、Y、Z三种元素的原子序数最大的是 | |
A. |
X |
B. |
Y |
C. |
Z |
D. |
无法判断 |
|
氢化钠(NaH)是一种白色的离子晶体,其中钠是+1价.NaH与水反应放出氢气.下列叙述中正确的是 | |
A. |
NaH在水中显酸性 |
B. |
NaH中氢离子的电子层排布与氦原子相同 |
C. |
NaH中氢离子半径比锂离子半径大 |
D. |
NaH中氢离子可被还原成氢气 |