|
下列物质性质递变正确的是 | |
A. |
原子半径:C、Al、K依次增大 |
B. |
热稳定性:HF、NH3、SiH4依次增强 |
C. |
氧化物对应水化物的酸碱性:NaOH、Al(OH)3、H2SiO3酸性增强,碱性减弱 |
D. |
还原性:Si、P、S依次增强 |
|
由两种短周期元素X和Y可组成化合物XY3,当X的原子序数为m时,Y的原子序数可能是 ①m+4 ②m-8 ③m+2 ④m-6 ⑤m-14 ⑥m+12,其中正确的组合是 | |
A. |
①②③ |
B. |
①④⑤⑥ |
C. |
①②④⑤⑥ |
D. |
①②③④⑤⑥ |
|
氯元素有35Cl和37Cl两种同位素,在自然界中35Cl和37Cl原子个数比为3∶1,则自然界中相对分子质量为70、72、74的Cl2分子个数比为 | |
A. |
5∶2∶1 |
B. |
5∶2∶2 |
C. |
9∶3∶1 |
D. |
9∶3∶2 |
|
一定量的铝铁合金与300 mL 2 mol·L-1的硝酸完全反应,生成3.36 L NO(标准状况)、三价铁盐和铝盐等,向反应后的溶液中加入3 mol·L-1 NaOH溶液恰好使Al3+、Fe3+完全反应并生成沉淀量最多.则所加入NaOH溶液的体积是 | |
A. |
150 mL |
B. |
300 mL |
C. |
450 mL |
D. |
600 mL |
|
把a L含(NH4)2SO4和NH4NO3的混合液分成两等份.一份用b mol烧碱刚好把NH3全部赶出;另一份与BaCl2溶液完全反应,消耗c mol BaCl2.则原溶液中硝酸根离子的浓度为 | |
A. |
|
B. |
|
C. |
|
D. |
|
|
氢化铵(NH4H)与氯化铵的结构相似,又知NH4H与水反应有H2生成,下列叙述不正确的是 | |
A. |
NH4H是离子化合物,固态时属离子晶体 |
B. |
NH4H溶于水,所形成的溶液显酸性 |
C. |
NH4H固体投入少量的水中,有两种气体产生 |
D. |
NH4H与水反应时,NH4H是氧化剂 |
|
充分煅烧黄铁矿W g,反应完全后,冷却至室温,称得固体物质的质量是m g,生成SO2为V L,则黄铁矿中FeS2的含量是(假设矿石中的杂质受热不分解,也不会与SO2反应) | |
A. |
|
B. |
|
C. |
|
D. |
|
|
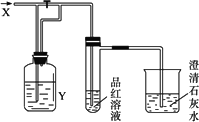
下图是一套检验气体性质的实验装置图,向装置中缓慢通入气体X.若关闭活塞,澄清石灰水变浑浊,打开活塞,则品红溶液褪色.据此判断气体X和洗气瓶内的溶液Y分别可能是
| |
A. |
X是SO2,Y是饱和NaHCO3 |
B. |
X是H2S,Y是浓H2SO4 |
C. |
X是CO2,Y是Na2SO3 |
D. |
X是Cl2,Y是Na2SO3 |