|
实验测得在常温下0.1 mol·L-1某一元碱(BOH)pH≠13,0.1 mol·L-1的某一元酸(HA)溶液中, | |
| [ ] | |
A. |
C(A-)>C(B+)>C(H+)>C(OH-) |
B. |
C(B+)>C(A-)>C(H+)>C(OH-) |
C. |
C(B+)>C(A-)>C(OH-)=C(H+) |
D. |
C(A-)>C(B+)>C(OH-)>C(H+) |
|
碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,电解质是KOH.下列说法正确的是 | |
| [ ] | |
A. |
MnO2发生了氧化反应 |
B. |
MnOOH中Mn元素的化合价为+3 |
C. |
反应消耗0.65 g Zn,有0.01 mol电子发生转移 |
D. |
电池正极的反应为:Zn+2OH-–2e- |
|
下列各选项所描述的两个量中,前者一定大于后者的是 | |
| [ ] | |
A. |
pH=3的盐酸的Cl-浓度和pH=3的醋酸溶液的CH3COO-浓度 |
B. |
pH相同的氨水和醋酸钠溶液中,由水电离产生的c(H+) |
C. |
中和100 mL PH=1的醋酸和100 mL PH=1的盐酸所消耗的NaOH的物质的量 |
D. |
pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH |
|
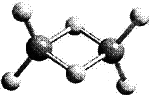
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如下图.下列有关说法肯定错误的是
| |
| [ ] | |
A. |
Al2H6在固态时所形成的晶体是分子晶体 |
B. |
氢铝化合物可能成为未来的储氢材料和火箭燃料 |
C. |
Al2H6在空气中完全燃烧,产物为氧化铝和水 |
D. |
Al2H6中含有离子键和极性共价键 |
|
下列说法中错误的是 | |
| [ ] | |
A. |
若XY4分子中X原子处于正四面体的中心,则XY4分子为非极性分子 |
B. |
C2H5OH与C2H5Br相比,前者的相对分子质量远小于后者,而沸点却远高 于后者,其原因是前者的分子间存在氢键 |
C. |
CO2与SiO2晶体熔化时,所克服的微粒间相互作用不同 |
D. |
短周期元素离子aXn-和bYm-具有相同的电子层结构,若a>b,则n>m |
|
继科学家发现C3O2是金星大气成分之后,2004年,美国科学家通过“勇气”号太空车探测出水星大气中含有一种称为硫化羰(化学式为COS)的物质.已知硫化羰与二氧化碳的结构相似,但在氧气中会燃烧,下列有关C3O2与硫化羰的说法中正确的是 | |
| [ ] | |
A. |
C3O2可以在氧气中完全燃烧生成CO2 |
B. |
C3O2和CO2都是碳的氧化物,它们互为同分异构体 |
C. |
COS是由极性键构成的非极性分子,分子中所有原子都满足8电子稳定结构 |
D. |
COS在氧气中完全燃烧后,生成物是CO2和SO3 |
|
中学化学中很多规律都有其使用范围,下列根据有关“规律”推出的结论合理的是 | |
| [ ] | |
A. |
根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 |
B. |
根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 |
C. |
根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性 |
D. |
根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
|
短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是 | |
| [ ] | |
A. |
若XY2是共价化合物,则X与Y的原子序数可能相差1 |
B. |
若XY2是离子化合物,则X与Y的原子序数可能相差8 |
C. |
若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
D. |
若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
|
有A、B、C、D四种短周期元素,A、B元素的阳离子和C、D元素的阴离子都具有相同的电子层结构,且A单质的还原性比B单质的还原性强,C的阴离子所带负电荷比D的阴离子所带负电荷多,则A、B、C、D的原子序数大小关系是 | |
| [ ] | |
A. |
B>A>C>D |
B. |
C>B>A>D |
C. |
A>B>C>D |
D. |
B>A>D>C |
|
在恒温恒容条件下,向容积为2 L的密闭容器中充入2.0 mol SO2和2.0 mol O2.已知2SO2(g)+O2(g) | |
| [ ] | |
A. |
在1 min时:c(SO3)+c(SO2)=1.0 mol·L-1 |
B. |
在2 min内:v(SO2)=0.25 mol·L-1·min-1 |
C. |
若再充入2 molSO3,达到平衡时SO3的质量分数减小 |
D. |
反应条件相同,若起始时向反应容器充入2 molSO3,达到平衡时反应吸热0.75a kJ |