|
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外层电子层结构,则下列有关说法中,不正确的是 | |
| [ ] | |
A. |
NH5中既有离子键又有共价键 |
B. |
NH5的熔沸点高于NH3 |
C. |
NH5固体投入少量水中,可产生两种气体 |
D. |
1 mol NH5中含有5 mol N-H键 |
|
下列的叙述中不正确的是 | |
| [ ] | |
A. |
卤化氢分子中,卤素的非金属性越强,共价键的极性越强,稳定性也越强 |
B. |
以非极性键结合的分子,不一定是非极性分子 |
C. |
判断A2B或AB2型分子是否是极性分子的依据是,具有极性键且分子构型不对称、键角小于180°的非直线型结构 |
D. |
非极性分子中,各原子间都应以以非极性键结合 |
|
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 | |
| [ ] | |
A. |
原子半径:a>c>d>b |
B. |
电负性:a>b>d>c |
C. |
最高价含氧酸的酸性:c>d>a |
D. |
第一电离能:d>a>b>c |
|
在周期表主族元素中,甲元素与乙、丙、丁三元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20.下列判断中,正确的是 | |
| [ ] | |
A. |
原子半径;丙>乙>甲>丁 |
B. |
气态氢经物的稳定性:甲>丙 |
C. |
最高价氧化物对应水化物的酸性:丁>甲 |
D. |
乙和甲或乙和丁所能形成的化合物都是有毒物质 |
|
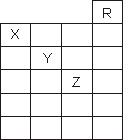
如下图是元素周期表前六周期的一部分,关于元素X、Y、Z的叙述正确的是
①X的气态氢化物与Y最高价氧化物对应的水化物能发生反应生成盐 ②X、Y、Z的气态氢化物的水溶液的酸性X<Y<Z ③Z的单质常温下是液体,可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素 | |
| [ ] | |
A. |
只有③ |
B. |
只有①④ |
C. |
只有①②③④ |
D. |
①②③④⑤ |
|
下表为元素周期表中短周期的一部分.下列有关A、B、C、D、E五种元素的叙述中,不正确的是
| |
| [ ] | |
A. |
A与B形成的阴离子可能有:AB32-、A2B42- |
B. |
E的氢化物的沸点比C的氢化物的沸点高 |
C. |
D在过量的B中燃烧的主要产物为DB2 |
D. |
A与E形成的化合物是非极性分子 |
|
已知反应:①101 kPa时,2C(s)+O2(g) | |
| [ ] | |
A. |
碳的燃烧热大于110.5 kJ/mol |
B. |
①的反应热为221 kJ/mol |
C. |
稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
D. |
稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
|
室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol/L,满足此条件的溶液中一定可以大量共存的离子组是 | |
| [ ] | |
A. |
Al3+、Na+、NO3-、Cl- |
B. |
K+、Na+、Cl-、NO3- |
C. |
K+、Na+、Cl-、AlO2- |
D. |
K+、NH4+、SO42-、NO3- |