|
已知:CH4(g)+2O2(g)→CO2(g)+2H2O(g);ΔH=-Q1 kJ/mol; 2H2(g)+O2(g) H2O(g) 常温下取体积比为4∶1的甲烷和H2的混合气体112 L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为 | |
| [ ] | |
A. |
4Q1+0.5Q2 |
B. |
4Q1+Q2+10Q3 |
C. |
4Q1+2Q2 |
D. |
4Q1+0.5Q2+9Q3 |
|
已知:2H2(g)+O2(g)=2H2O(l);ΔH=-571.6 KJ·mol-1 CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH=-890 KJ·mol-1 现有H2与CH4的混合气体112 L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695 KJ,则原混合气体中H2与CH4的物质的量之比是 | |
| [ ] | |
A. |
1∶1 |
B. |
1∶3 |
C. |
1∶4 |
D. |
2∶3 |
|
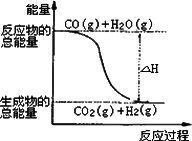
已知热化学方程式: ①CO(g)+1/2O2(g)=CO2(g);ΔH=-283.0 kJ·mol-1 ②H2(g)+1/2O2(g)=H2O(g);ΔH=-241.8 kJ·mol-1 则下列说法正确的是 | |
| [ ] | |
A. |
H2的燃烧热为241.8 kJ·mol-1 |
B. |
由反应①、②可知下图所示的热化学方程式为CO(g)+H2O(g)=CO2(g)+H2(g);ΔH=-41.2 kJ·mol-1
|
C. |
H2(g)转变成H2O(g)的化学反应一定要释放能量 |
D. |
根据②推知反应H2(g)+1/2O2(g)=H2O(l)ΔH>-241.8 kJ·mol-1 |
|
已知常温时红磷比白磷稳定,在下列反应中 P4(白磷,s)+5O2(g) 4P(红磷,s)+5O2(g) 若a、b均大于零,则a和b的关系为 | |
| [ ] | |
A. |
a<b |
B. |
a>b |
C. |
a=b |
D. |
无法确定 |
|
不管化学反应过程是一步完成还是分为数步完成,这个过程的热效应是相同的. 已知:①H2O(g) ②C2H5OH(g) ③C2H5OH(g)+3O2(g) 若使23 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为 | |
| [ ] | |
A. |
Q1+Q2+Q3 |
B. |
0.5(Q1+Q2+Q3) |
C. |
0.5Q1-1.5Q2+0.5Q3 |
D. |
1.5Q1-0.5Q2+0.5Q3 |
|
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O | |
| [ ] | |
A. |
920 kJ |
B. |
557 kJ |
C. |
436 kJ |
D. |
188 kJ |
|
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是285.8 kJ·mol-1、1411.0 kJ·mol-1和1366.8 kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为 | |
| [ ] | |
A. |
-44.2 kJ·mol-1 |
B. |
+44.2 kJ·mol-1 |
C. |
--330 kJ·mol-1 |
D. |
+330 kJ·mol-1 |
|
已知:①101 kPa时,2C(s)+O2(g) ②稀溶液中,H+(aq)+OH-(aq) | |
| [ ] | |
A. |
碳的燃烧热大于110.5 kJ/mol |
B. |
①的反应热为221 kJ/mol |
C. |
稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
D. |
浓硫酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
|
据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O | |
| [ ] | |
A. |
①② |
B. |
②③ |
C. |
③④ |
D. |
①②③④ |