|
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是 | |
| [ ] | |
A. |
铝钠合金是混合物 |
B. |
铝钠合金若投入一定的水中可得无色溶液,则n(Al)≤n(Na) |
C. |
铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀也可能有铜析出 |
D. |
若mg不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
|
溴、碘主要存在于海水中,有“海洋元素”的美称.海水中的碘富集在海藻中,我国海带产量居世界第一,除供食用外,大量用于制碘.提取碘的途径如下所示:
下列有关叙述正确的是 | |
| [ ] | |
A. |
碘元素在海水中也有游离态存在 |
B. |
操作A是结晶或重结晶 |
C. |
B是提纯操作,常用蒸馏 |
D. |
在提取的过程中用的氧化剂可以是H2O2 |
|
一定条件下,碘单质与砹单质以等物质的量进行反应,可得AtI.它与Zn、NH3都能发生反应,化学方程式分别如下:2AtI+2Zn | |
| [ ] | |
A. |
ZnI2既是氧化产物,又是还原产物 |
B. |
ZnAt2既是氧化产物,又是还原产物 |
C. |
AtI与液氨反应,AtI既是氧化剂,又是还原剂 |
D. |
AtI与液氨的反应中,得失电子数相等 |
|
甲、乙、丙三种溶液中各含有一种X-(X-为Cl-、Br-或I-),向甲溶液中加入淀粉溶液和氯水,则溶液变为橙色,再加入丙溶液,颜色无明显变化.则甲、乙、丙依次含有的卤素离子有 | |
| [ ] | |
A. |
Br-、Cl-、I- |
B. |
Cl-、I-、Br- |
C. |
I-、Br-、Cl- |
D. |
Br-、I-、Cl- |
|
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是
| |
| [ ] | |
A. |
A装置的气球膨胀速率大 |
B. |
若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L |
C. |
若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L |
D. |
最终两试管中Na+、Cl-的物质的量一定相同 |
|
下列离子方程式正确的是 | |
| [ ] | |
A. |
用FeCl3溶液腐蚀印刷电路板:Fe+3+Cu |
B. |
惰性电极电解氯化钠溶液:2Cl-+2H2O |
C. |
氢氧化钙溶液与碳酸氢镁溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
D. |
向Fe(OH)3悬浊液中加入醋酸:Fe(OH)3+3H+=Fe3++3H2O |
|
现有下列物质 ①2.3 g Na ②6.2 g Na2O ③7.8 g Na2O2 ④4.0 g NaOH,把它们分别放入100 g水中,对所得的溶液的质量分数中正确的是 | |
| [ ] | |
A. |
③>②>①>④ |
B. |
③=②>①>④ |
C. |
④>③>②>① |
D. |
③=②>④=① |
|
下列能够检验出KI中是否含有Br一的实验是 | |
| [ ] | |
A. |
加入足量的新制氯水,溶液变色则有Br- |
B. |
加入酸性KMnO4溶液,观察溶液颜色是否褪去 |
C. |
加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br- |
D. |
加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
|
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O | |
| [ ] | |
A. |
该反应的氧化剂只有Cu2O |
B. |
Cu2S在反应中既是氧化剂,又是还原剂 |
C. |
Cu既是氧化产物又是还原产物 |
D. |
每生成19.2 g Cu,反应中转移1.8 mol电子 |
|
有下列符号:35Cl和37Cl、O2和O3、1H216O和2H218O.下列有关说法正确的是 | |
| [ ] | |
A. |
35 Cl和37Cl互称为同素异形体 |
B. |
O2和O3是氧元素的两种同位素 |
C. |
35和37表示的是质量数 |
D. |
1 H216O和2H218O的相对分子质量相同 |

 ZnI2+ZnAt2 AtI+2NH3(1)
ZnI2+ZnAt2 AtI+2NH3(1) NH4I+At NH2.下列叙述正确的是
NH4I+At NH2.下列叙述正确的是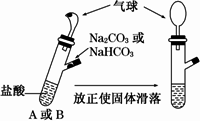
 Fe2++Cu2+
Fe2++Cu2+ 6Cu+SO2↑,关于该反应的说法中,正确的是
6Cu+SO2↑,关于该反应的说法中,正确的是