|
白磷与氧可发生如下反应:P4+5O2
| |
| [ ] | |
A. |
(6a+5d-4c-12b)kJ·mol-1 |
B. |
(4c+12b-6a-5d)kJ·mol-1 |
C. |
(4c+12b-4a-5d)kJ·mol-1 |
D. |
(4a+5d-4c-12b)kJ·mol-1 |
|
已知在 298 K时下述反应的有关数据:C(s)+ CO(g) ΔH1=-110.5 kJ·mol-1 CO(g) ΔH1=-110.5 kJ·mol-1
C(s)+O2(g) 则 C(s)+CO2(g) 2CO(g)的ΔH为 2CO(g)的ΔH为
| |
| [ ] | |
A. |
+283.5 kJ·mol-1 |
B. |
+172 .5 kJ·mol-1 |
C. |
-172 .5 kJ·mol-1 |
D. |
-504 kJ·mol-1 |
|
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g) | |
| [ ] | |
A. |
体系压强不变 |
B. |
单位时间消耗n mol A,同时生成2n mol C |
C. |
A的转化率不变 |
D. |
容器内气体密度不变 |
|
在10℃时某化学反应速率为0 .1 mol/(L·s),若温度每升高10℃反应速率增加到原来的2倍.为了把该反应速率提高到1.6 mol/(L·s),则该反应需在什么温度下进行 | |
| [ ] | |
A. |
30℃ |
B. |
40℃ |
C. |
50℃ |
D. |
60℃ |
|
如图所示 ,ΔH1=-393.5 kJ·mol-1,ΔH2=-395.4 kJ·mol-1,下列说法或表示式正确的是
| |
| [ ] | |
A. |
C(s、石墨)=C(s、金刚石) ΔH=+1 .9 kJ·mol-1 |
B. |
石墨和金刚石的转化是物理变化 |
C. |
金刚石的稳定性强于石墨 |
D. |
1 mol石墨的总键能比1 mol金刚石的总键能小1 .9 kJ |
|
某温度下 ,反应SO2(g)+ SO3(g)的平衡常数K1=50,在同一温度下,反应:2SO3(g) SO3(g)的平衡常数K1=50,在同一温度下,反应:2SO3(g) 2SO2(g)+O2(g)的平衡常数K2的值为 2SO2(g)+O2(g)的平衡常数K2的值为
| |
| [ ] | |
A. |
2500 |
B. |
100 |
C. |
4×10-4 |
D. |
2×10-2 |
|
强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ΔH=-57 .3 kJ/mol.向1 L 0.5 mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是 | |
| [ ] | |
A. |
ΔH1>ΔH2>ΔH3 |
B. |
ΔH1<ΔH3<ΔH2 |
C. |
ΔH1<ΔH2<ΔH3 |
D. |
ΔH1>ΔH3>ΔH2 |
|
甲烷是一种高效清洁的新能源,0 .25 mol甲烷完全燃烧生成液态水时放出222.5 kJ热量,则下列热化学方程式中正确的是 | |
| [ ] | |
A. |
2CH4(g)+4O2(g) |
B. |
CH4(g)+2O2(g) |
C. |
CH4(g)+2O2(g) |
D. |
2CH4(g)+4O2(g) |
|
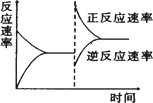
下图是关于反应A2(g)+3B2(g)
| |
| [ ] | |
A. |
升高温度,同时加压 |
B. |
降低温度,同时减压 |
C. |
增大反应物浓度,同时减小生成物浓度 |
D. |
增大反应物浓度,同时使用催化剂 |
|
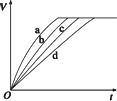
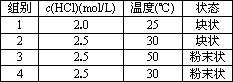
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得下图,则曲线a、b、c、d所对应的实验组别可能是
| |
| [ ] | |
A. |
4-3-2-1 |
B. |
1-2-3-4 |
C. |
3-4-2-1 |
D. |
1-2-4-3 |
 P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是
P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是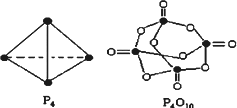
 CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1 2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是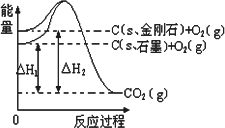
 2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=+890 kJ·mol-1 CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=+890 kJ·mol-1 CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1
2CO2(g)+4H2O(l) ΔH=-890 kJ·mol-1 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是