某地环保部门取一定量某工厂所排废水试样分成甲、乙、丙、丁四份,进行如图所示探究.

已知废水试样中可能含有下表在的离子
| 离子 | |
| 阳离子 | Na+,Mg2+,X |
| 阴离子 | Cl-,S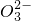 ,Y,N ,Y,N |
(1)离子X是______(填化学式,下同),离子Y是______.
(2)表中不能确定是否存在的阴离子是______,能证明该阴离子是否存在的简单实验操作为______.
(3)写出废水试样中滴加淀粉一KI溶液所发生反应的离子方程式______:
有关钴和铁化合物的性质见下表:
| 化学式 | 溶度积(室温时)Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2?6H2O呈红色,常温下稳定.110°C~120°C时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.0×10-35 | x |
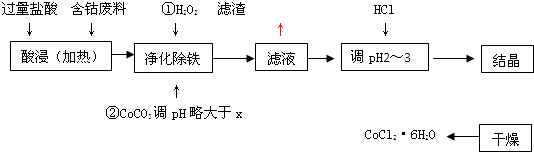
试回答:
(1)“净化除铁”中,写出加入CoCO3(难溶)调pH时反应的离子方程式______
(2)滤液中(Fe3+)≤1.0×10-5mol/L时,可视为Fe3+沉淀完全.试计算室温下,Fe(OH)3沉淀完全时,则x=______.
(3)②步中用CoCO3调pH略大于x的原因是______.
(4)滤液中所含溶质有______,______.
(5)为了防止CoCl2?6H2O脱水,“干燥”时宜采用的方法或操作是______,______.
 Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
 (1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=______,R元素在RO3n-中的化合价是______.
(1)已知离子反应:RO3n-+6I-+6H+=R-+3I2+3H2O,n=______,R元素在RO3n-中的化合价是______. (用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是______.
(用单线桥表示电子转移的方向、数目)当反应中有3mol电子转移时,氧化产物的质量是______.