某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升.若用同样的铝片投入同浓度的硫酸
铜溶液中,在短时间内铝片无明显变化.
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是______.(填序号)
A.生成氯化铝溶于水,而生成硫酸铝不溶于水
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
(2)铝片表面出现的暗红色物质是______.
(3)放出的气体是______,请从有关物质的浓度、能量、是否有电化学作用等分析开始阶段产生气体的速率不断加快的其中一种原因是______.
(4)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是______.
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(5)除去氧化铝的铝片与镁片为电极,在 X 电解质溶液中构成原电池,列表如下:
| 选项 | 铝电极 | 电解质 | 负极反应 | 正极反应 |
| A | 负极 | NaOH | 2Al-6e-+8OH-=2AlO2-+4H2O | 6H2O+6e-=6OH-+3H2↑ |
| B | 负极 | 稀盐酸 | 2Al-6e-=2Al3+ | 6H++6e-=3H2↑ |
| C | 正极 | 浓硝酸 | Mg+2e-=Mg2+ | 2NO3-+4H+-4e-=2NO2↑+2H2O |




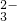 、Cl-
、Cl- 如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是
如图是a、b两种固体物质的溶解度曲线,下列说法中,正确的是