 为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案.
为测定含有Na2O杂质的Na2O2样品的纯度,甲、乙二位同学设计了二种不同的实验方案.
已知:2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2
甲:用图l所示装置,通过测定Na2O2与CO2反应生成O2的体积来测定样品的纯度.
(1)C中所盛的药品是:______.
(2)A中橡皮管的作用是:______.
(3)利用该实验方案所测Na2O2的纯度明显偏大,其原因可能是______(填选项字母).
a.装置A、B中的空气对测定结果产生了影响
b.装置C中的空气对测定结果产生了影响
c.读数时U形量气管中的液面左高右低
d.读数时U形量气管中的液面左低右高
乙:称取3.500g试样,配成1000.00mL溶液,用0.1000mol?L-1的标准盐酸滴定.
(4)取上述所配溶液25.00mL于锥形瓶中,操作如下图所示(手持部分省略):正确的操作是图______,取溶液所用仪器的名称是______.

(5)滴定操作平行实验的数据记录如下表:
| 滴定次数 | 第一次滴定 | 第二次滴定 | 第三次滴定 |
| 消耗标准盐酸的体积(mL) | 24.98 | 25.00 | 25.02 |
 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之 后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是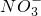 ⑤S2-⑥
⑤S2-⑥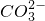 ⑦
⑦ ⑧Mg2+⑨Al3+ ⑩
⑧Mg2+⑨Al3+ ⑩ 离子.其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是
离子.其实,这些离子中有一部分不必再鉴定就能加以否定,你认为不必鉴定的离子组是 H2(g)+
H2(g)+
 、Fe3+
、Fe3+