随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.
Ⅰ.MnFe2O4的制备:
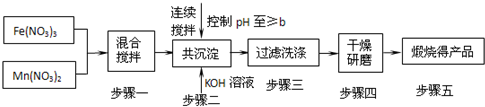
已知Fe3+、Mn2+沉淀的pH为表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(2)步骤二中b的值为______.
(3)步骤三中洗涤干净的标准是______.
Ⅱ.用MnFe2O4热化学循环制氢:
MnFe2O4(s)
 MnFe2O(4-x)(s)+
MnFe2O(4-x)(s)+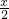 O2(g)△H1
O2(g)△H1MnFe2O(4-x)(s)+xH2O→MnFe2O4(s)+xH2(g)△H2
请回答下列问题:
(4)若MnFe2O(4-x)中x=0.8,则MnFe2O(4-x)中Fe2+占全部铁元素的百分率为______.
(5)该热化学循环制氢的优点有______(填序号).
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
(6)已知 2H2(g)+O2(g)=2H2O(g)△H3则:△H3与△H1、△H2的关系为△H3=______.
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在有______
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.

(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式均可以表示一类反应 | |
| ②酸碱中和反应均可表示为:H++OH-=H2O |



